重磅综述丨神经酰胺与脑血管疾病
神经酰胺
神经酰胺是一种具有生物活性的鞘脂,在细胞信号转导中起着第二信使的重要作用。在应激条件下,它可以通过从头合成、鞘磷脂水解和/或补救途径产生。大脑富含脂质,脂质水平异常与多种脑部疾病有关。脑血管病主要由脑血流异常和继发性神经损伤引起,是世界范围内导致死亡和残疾的主要原因。越来越多的证据表明,神经酰胺水平升高与脑血管疾病,特别是中风和脑小血管疾病(CSVD)之间存在密切联系。神经酰胺的增加对不同类型的脑细胞有广泛的影响,包括内皮细胞、小胶质细胞和神经元。因此,减少神经酰胺合成的策略,如调节鞘磷脂酶活性或从头合成途径的限速酶——丝氨酸棕榈酰基转移酶,可能代表着预防或治疗脑血管损伤相关疾病的新的有前途的治疗方法。
首都医科大学附属北京天坛医院的赵志刚研究团队于2023年6月在Frontiers in Cellular Neuroscience期刊上发表题为“Ceramide in cerebrovascular diseases”的综述,对神经酰胺的生物合成、在疾病发生发展过程中的水平变化、在不同细胞中的表达及机制等进行了详细阐述和探索。原文链接:https://doi.org/10.3389/fncel.2023.1191609。

简介
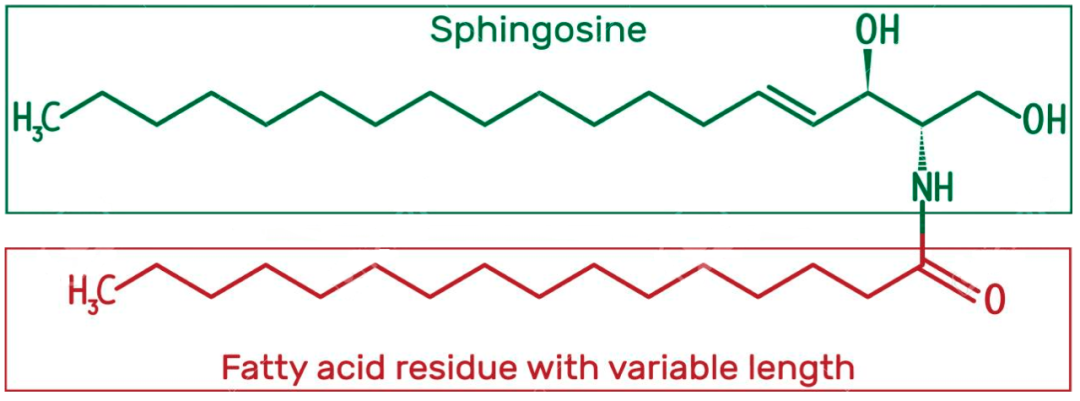
真核细胞使用大约5%的基因和大量资源合成数千种不同的结构和功能脂质,这些脂质在许多生理过程中至关重要,如代谢中的能量储存,提供细胞膜的基本结构元件,以及在信号转导和分子识别过程中作为第一或第二信使。然而,异常脂质储存在许多疾病中起着关键作用。在所有脂质研究中,胆固醇和甘油三酯可能是最为人熟知的,因为它们是广泛使用的代谢性疾病的临床生物标志物和治疗干预靶点。除了胆固醇和甘油三酯外,最近的研究还显示了其他脂类在多种疾病中的病理作用,如鞘脂、糖脂。神经酰胺是一类生物活性鞘脂,由脂肪酸链和鞘磷脂主链组成,链长14~26个碳,是鞘脂代谢的核心分子。神经酰胺除了是细胞膜的基本成分外,还作为关键的信号介质调节许多细胞过程,如健康和疾病状态下的增殖、存活、凋亡、自噬和炎症,使其也被称为第二信使。在过去的十年中,许多研究揭示了神经酰胺与各种疾病的发展之间的密切联系,包括神经系统疾病、癌症、心血管疾病、肝脏疾病、肾脏疾病、肠病、肥胖,表明神经酰胺可能是一个潜在的治疗靶点。
脑血管疾病主要由脑血流异常和继发性神经损伤引起,是世界范围内导致死亡和残疾的主要原因。全球人口老龄化大大增加了脑血管疾病的患病率,给世界各地的社会和卫生保健系统带来了沉重的负担。中风,特别是缺血性中风,是最常见的脑血管疾病之一,是全世界成年人死亡的第二大原因和残疾的第三大原因。据世界卫生组织估计,每年有110多万人死于缺血性中风,这对人类健康构成严重威胁。脑小血管病现在被认为是中风的主要原因,也是血管性痴呆的最常见原因,在普通人群中普遍存在,影响了5%的50岁人群到几乎100%的90岁以上人群。此外,脑血管疾病还包括颈动脉狭窄、脑动脉瘤、动静脉畸形等。尽管近年来脑血管疾病的研究取得了重大进展,但由于缺乏对其病理生理机制的了解,这些疾病仍然难以攻克。因此,更好地了解脑血管疾病的病理机制,寻找新的有效的靶点已成为该领域的主要研究课题。
众所周知,大脑的脂质含量仅次于脂肪组织,脂质代谢紊乱与许多年龄相关的脑部疾病有关。在衰老过程中,神经酰胺在多个组织(如肝脏和大脑)中积累,新出现的证据表明,神经酰胺是脑血管疾病(包括中风和脑小血管病)中失调最严重的脂质,动物和细胞模型也证明神经酰胺病理生物学调控的改变会影响中风的发生。因此,神经酰胺被认为是脑血管疾病早期诊断和治疗的一种有前景的生物标志物。理解神经酰胺在脑血管疾病中的复杂作用需要有充分的神经酰胺生物合成知识。因此,本综述的第一部分概述了神经酰胺合成的途径,然后重点介绍神经酰胺在中风、脑小血管病及其相关危险因素中的失调,并讨论不同类型卒中和脑小血管病的潜在机制。
神经酰胺的生物合成
神经酰胺属于脂质分子家族,由鞘氨酸和脂肪酸经酰胺键连接组成。神经酰胺的种类很多,通过与鞘氨醇结合的脂肪酸酰基链的不同长度来区分,其中以非羟基棕榈酸(C16:0)和硬脂酸(C18:0)脂肪酸最为丰富。神经酰胺被认为是神经脂代谢的核心枢纽,可以影响关键的代谢功能,神经酰胺水平的失衡可导致多种疾病。目前已经报道了30多种与神经酰胺代谢有关的酶,这些酶参与高度保守和严格调控的代谢过程。神经酰胺的代谢主要有三条途径:从头合成途径、鞘磷脂酶水解途径和补救途径(图1)。此外,神经酰胺1-磷酸磷酸酶(CPP)催化的神经酰胺1-磷酸(C1P)去磷酸化亦可合成神经酰胺。C1P参与多种生物功能,包括增殖/存活、迁移、代谢和炎症。
从头合成途径主要发生在内质网细胞质小叶,线粒体中也发现了这种途径的存在。丝氨酸棕榈酰转移酶(SPT)是催化从头合成途径第一步反应的酶,是神经酰胺合成的主要限速酶,通过棕榈酰辅酶a和丝氨酸的缩合反应生成3-酮鞘氨酸,随后由3-酮鞘氨酸还原酶催化生成鞘氨酸,接下来,在一组称为神经酰胺合成酶(CerS)的内质网驻留酶的催化下,酰基辅酶a链与鞘氨氨酸结合形成二氢神经酰胺。迄今为止,已在哺乳动物中鉴定出6种CerS (CerS1-6)亚型,每个CerS都有特定的脂肪酰基底物偏好,从而合成具有特定酰基链长度的二氢神经酰胺。例如, CerS1对C18-乙酰辅酶a表现出高特异性,从而生成C18二氢神经酰胺,而CerS2更倾向于生成C22/24二氢神经酰胺。此外,CerS各亚型在组织中的分布也不同。除了CerS5和CerS6在绝大多数组织中表达水平相对较低外,其他CerS在一种或几种组织中都有丰富的表达。CerS1在小鼠脑和骨骼肌中高度表达,但在其他组织中几乎检测不到;CerS2在大多数小鼠组织中广泛表达;CerS3在小鼠睾丸和皮肤中表达量最高;CerS4在小鼠皮肤、心脏和肝脏中高度表达。从头合成途径的最后,二氢神经酰胺去饱和酶通过在4-5反式位置引入双键将二氢神经酰胺转化为神经酰胺。神经酰胺一旦合成,立即通过囊泡和非囊泡机制运输到高尔基体,在那里它们可以进一步合成复杂的鞘脂,如鞘磷脂和糖基神经酰胺。
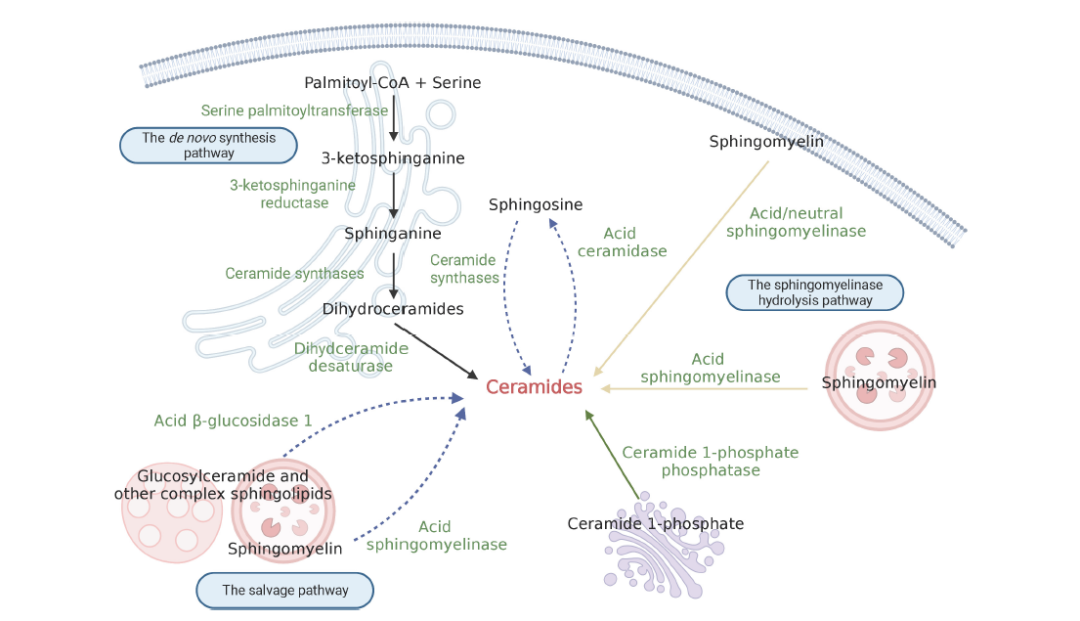
图1. 神经酰胺生物合成的示意图。黑色实线箭头表示从头合成途径;黄色实线箭头表示鞘磷脂酶水解途径;蓝色虚线箭头表示补救合成途径。
鞘磷脂酶水解途径发生在生物膜上,如溶酶体膜和细胞质膜。在这一途径中,神经酰胺是由鞘磷脂酶催化鞘磷脂(SM)水解产生的。在细胞应激条件下,如活性氧(ROS)、肿瘤坏死因子(TNF-a)、促炎细胞因子白细胞介素1b (IL-1b)、病毒和细菌感染等,鞘磷脂酶可以被激活,从而导致鞘磷脂快速水解成神经酰胺,介导下游信号转导过程。因此,水解途径产生的神经酰胺是治疗细胞应激反应的重要来源。根据催化最适pH,鞘磷脂酶可分为酸性鞘磷脂酶(ASM)、中性鞘磷脂酶(NSM)和碱性鞘磷脂酶(alk-SM)三种亚型。ASM是研究最多的鞘磷脂酶之一,主要定位于溶酶体和细胞质膜。一般认为ASM的最适pH值在4.5 ~ 5.0之间,但也有研究发现ASM在接近中性pH的条件下可以水解脂蛋白鞘磷脂。NSM的表达在细胞核、内质网和质膜中均有检测,而Alk-SM在肠绒毛和人胆汁中表达。与其他两种鞘磷脂酶不同,alk-SM还能水解血小板活化因子和溶血磷脂酰胆碱。值得注意的是,ASM和NSM参与了信号转导,而alk-SM则参与了饮食中鞘磷脂的降解。
补救途径主要发生在溶酶体或晚期内吞体等酸性亚细胞器中,在这些细胞器中,神经酰胺的形成参与了糖基神经酰胺、鞘磷脂和其他复合鞘脂的降解。与ASM水解鞘磷脂不同,葡萄糖神经酰胺通过酸性b-葡萄糖苷酶1转化为神经酰胺。此外,这些过程产生的神经酰胺可以通过酸性神经酰胺酶的去乙酰化分解,生成鞘氨醇碱和脂肪酸链。鞘氨醇碱可以从溶酶体释放到内质网,为从头合成途径提供底物。鞘氨醇再循环的这一途径也因此被称为“补救途径”。值得注意的是,补救途径需要酸性细胞室中许多酶的作用。这些酶的缺陷,如溶酶体疾病中所见,可能导致补救途径的功能障碍。
神经酰胺在脑血管疾病中的作用
众所周知,大脑富含鞘脂,因此对鞘脂含量的变化非常敏感。神经酰胺作为所有鞘脂的关键前体,是细胞内应激反应的核心成分。越来越多的临床前和临床研究证据支持神经酰胺与脑血管疾病之间的密切联系。
3.1中风
中风被定义为由血管引起的中枢神经系统(CNS)急性局灶性损伤引起的神经功能缺陷,可以是缺血性的,也可以是出血性的。由动脉闭塞引起的缺血性中风是大多数中风的原因。目前缺血性脑卒中的治疗试图通过静脉溶栓和血管内取栓来恢复再灌注。这些方法确实改善了失功率,但时间至关重要,这给医疗系统造成了压力。出血性中风占中风的一小部分,但由于意识的突然恶化和神经功能障碍,其发病率和死亡率都很高。血管痉挛是蛛网膜下腔出血(SAH)的常见并发症,也是预后的主要决定因素。虽然使用药物可以有效地逆转血管痉挛,但它们并不能改善SAH相关的死亡率。因此,迫切需要新的非侵入性方法或药物治疗来预防或延缓脑卒中的进展,以提高患者的生活质量并降低死亡率。
一些中风动物模型表明,缺血/再灌注(IR)和出血性损伤脑中存在神经酰胺的增加。例如,在大脑中动脉闭塞24小时的自发性高血压大鼠中,脑神经酰胺含量在缺血核心区增加了595%,在焦周/半暗区增加了460%。在光血栓性卒中模型中,梗死周围皮层的总神经酰胺水平在第1天下降,但在第3天至第7天显著增加,最终在第28天恢复到正常水平。在瞬时脑缺血大鼠中,神经酰胺在皮质区1 (CA1)和齿状回(DG)区域的星形胶质细胞和小胶质细胞中积累。神经酰胺的积累似乎发生在再灌注阶段,因为缺血后如果无再灌注,则神经酰胺水平没有变化。在颈动脉末端血管内穿孔(ICA)大鼠模型中,脑匀浆中神经酰胺水平比对照组高2倍。增加的神经酰胺种类主要为内源性长链神经酰胺,如C16、C18、C20神经酰胺。有趣的是,衰老作为中风的一个重要因素,似乎也与长链神经酰胺的积累有关。一项研究发现,血浆C16:0神经酰胺与慢速步态有关,这是身体功能衰老的重要标志。老龄大鼠线粒体中有长链C16和C18神经酰胺的积累。小鼠短暂性大脑中动脉闭塞(tMCAO)再灌注60 min后,缺血核心及周围区域的Cer (d18:1/18:0)随时间累积。在卒中后第4天的梗死周围区域,代谢组学数据显示,Cer (d18:1/16:0)和Cer (d18:2/16:0)增加了约2倍。长链神经酰胺与超长链神经酰胺(酰基链长度不小于22)在脑缺血损伤中的变化趋势明显。超长链神经酰胺,包括Cer(18:1/23:0)和Cer(18:1/24:0),在MCAO后3 h显著降低。另一项基于超高效液相色谱四极杆飞行时间质谱(UPLC-Q-TOF/MS)的脂质组学分析鉴定脑卒中紊乱脂质代谢物的实验也证实了这一发现,MCAO后,Cer (d18:1/16:0)、Cer (d18:1/18:0)和Cer (d18:0/18:0)显著升高,而超长链Cer (d18:1/24:1)显著下调。
神经酰胺在脑卒中中的来源途径仍然不确定,因为已经发现了从头合成和鞘磷脂酶水解途径的证据。一些研究表明,神经酰胺水平的增加源于新生途径,因为新生途径的直接神经酰胺前体二氢神经酰胺相应增加,但无法检测到ASM和NSM活性或鞘磷脂种类含量的变化。肉豆蔻素是一种影响从头合成途径的丝氨酸棕榈酰转移酶(SPT)抑制剂,可以逆转神经酰胺干扰,减轻脑I/R损伤。此外,神经酰胺合成酶活性在中风期间发生改变,这似乎为神经酰胺起源于从头合成途径的观点提供了进一步的证据。IR刺激后线粒体神经酰胺合成酶活性增加。另一项支持这一观点的研究调查了Sirtuins 3 (SIRT3)在脑IR损伤时调节线粒体神经酰胺合成酶反应中的作用。SIRT3是一种主要的线粒体去乙酰化酶,参与代谢和线粒体稳态的调节。脑IR损伤触发神经酰胺积累、线粒体功能障碍和ROS的产生,最终促进脑损伤。敲除SIRT3可以通过增加CerS1、2和6的乙酰化来逆转神经酰胺的积累和脑损伤,这表明增加的神经酰胺来自从头合成途径。但也有研究者认为,缺血损伤中神经酰胺的产生是通过鞘磷脂酶途径,而不是通过新生途径。在一项研究中,血清/葡萄糖剥夺诱导NSM快速激活,导致神经酰胺含量增加。用小分子NSM抑制剂治疗可以抑制神经酰胺水平的增加,并显著减小脑梗死面积。
与内源性长链神经酰胺相反,外源性短链神经酰胺似乎在中风中发挥有益作用。这些短链神经酰胺,如C2和C8神经酰胺是一类合成的细胞渗透性神经酰胺。亚致死应激刺激,如短暂的全身性或局灶性缺血或全身性炎症治疗,可诱导对实验性缺氧和中风的耐受,导致梗死面积减小。TNF-α对这一过程至关重要,因为用TNF-α结合蛋白治疗可以消除耐受性。神经酰胺是TNF-α信号通路的下游信使。研究发现,脑室内注射预处理C2 -神经酰胺可使新生大鼠缺氧缺血性脑梗死体积减少45-65%。另一项研究证实了类似的观点,C2-和C8 -神经酰胺输注预处理可以显著减少梗死体积,分别减少约14%和17%。此外,植物神经酰胺对局灶性短暂性缺血性脑损伤也有有益作用。口服植物神经酰胺可显著减少MCAO/再灌注诱导的脑梗死和水肿,以及动物行为障碍的发生。
一系列的研究揭示了神经酰胺与中风患者之间的关系。在急性缺血性卒中患者中,与非卒中对照相比,长链神经酰胺显著增加,超长链神经酰胺显著减少。较高水平的神经酰胺与缺血性中风临床严重程度的高风险相关。重要的是,较高水平的Cer (d18:1/18:0)、Cer (d18:1/20:0)和Cer (d18:1/22:0)与较差的功能预后显著相关。在另一项研究中,与其他长链神经酰胺一样,超长链神经酰胺Cer (d18:1/24:1)明显高于对照组。此外,神经酰胺与出血性中风之间存在显著关联。与对照组相比,蛛网膜下腔出血(SAH)患者脑脊液中总神经酰胺水平较高。此外,与无症状血管痉挛患者相比,有症状的血管痉挛患者神经酰胺水平升高,特别是C18:0 Cer。此外,神经酰胺与脑卒中后的预后相关。基于神经酰胺和磷脂的心血管风险评分(CERT2)已被发现可预测心血管疾病事件的风险,该评分由四种神经酰胺/神经酰胺或神经酰胺/磷脂酰胆碱比率组成。有研究表明,CERT2风险评分与老年人脑卒中死亡率密切相关。抑郁症是一种神经精神疾病,常与中风有关。据报道,大约85%的中风患者有可能发展为抑郁症。最近的一项研究发现,与非卒中后抑郁(Non-PSD)患者相比,卒中后抑郁(PSD)患者血清神经酰胺(C16:0, C18:0, C24:0, C24:1 Cer)水平显著升高。
3.2 CSVD
脑血管病是一类以大脑小动脉、小动脉、毛细血管和小静脉受损为特征的病理过程。CSVD是导致认知障碍和痴呆的主要血管原因,也可能导致运动和平衡障碍,以及抑郁和冷漠等行为症状。因此,心血管疾病是向残疾过渡的主要风险因素,最近的数据表明,它也给低收入和中等收入国家带来了重大的健康负担。尽管心血管疾病的重要性和关注,目前的预防或治疗方法相当有限。到目前为止,最被广泛接受的治疗是控制可以干预的血管危险因素,改变不健康的生活方式。因此,迫切需要发现新的方法来延缓CSVD引起的临床表现。
在一项涉及20名年龄相关性CSVD患者和14名对照组的研究中,发现神经酰胺包括Cer (d34:2)、Cer (d36:4)、Cer (d16:0/18:1)、Cer (d38:6)、Cer (d36:3)和Cer (d32:0)与对照组相比增加。脑磁共振成像(MRI)显示的白质高强度信号(WMHs)是CSVD最常见的成像特征。较高的脑负荷总是与更严重的认知障碍相关,尤其是执行功能、处理速度和情景记忆。神经酰胺在人类白质束中高度富集,神经酰胺水平升高被认为与认知正常老年人皮层下白质损伤有关。在CSVD患者中,血清神经酰胺升高,尤其是C18和C20神经酰胺,也与皮层下微结构白质破坏有关。另一组58例患者接受了MRI检查,但没有临床卒中事件,研究人员分析了血浆鞘脂水平。研究发现,两种脑特异性鞘脂SM 38:1和Cer 34:1与高Fazekas评分(一种用于评价WMH程度的方法)显著相关。此外,CSVD的病变也与神经酰胺的变化有关。脑微出血(CMBs)和脑腔隙是CSVD常见的病变。在548例样本的队列中,阐明了血浆神经酰胺水平与CMBs和lacunes的存在和数量之间的关系。调整了年龄、性别、高血压和糖尿病因素的Logistic回归模型显示,神经酰胺C16:0/24:0比值的增加与任何CMB或大叶性CMB的几率显著相关,而且这种关联在女性中更强,可能是由于大多数神经酰胺水平在女性中高于男性。血管性痴呆(VaD)是指继发于包括CSVD在内的多发性脑血管病变的复杂神经认知功能障碍。与其他几项研究相反,一项招募了48名VaD患者和49名年龄和性别匹配的认知正常对照者的研究发现,VaD患者的长链神经酰胺和极长链神经酰胺都较低。
3.3. 脑血管疾病的危险因素
脑血管疾病,包括中风和CSVD,与其他心血管疾病有许多共同的危险因素,尽管它们的相对重要性可能有所不同。高血压是血管损伤最重要的危险因素。此外,糖尿病、高脂血症和缺乏运动也是重要的危险因素。许多研究已经提供证据表明神经酰胺与脑血管疾病的危险因素有关。
高血压是世界范围内血管疾病和死亡的主要危险因素。原发性高血压患者的血浆神经酰胺水平明显高于正常血压的健康对照组,且神经酰胺水平与高血压的严重程度相关。在Uppsala老年人队列研究中,在5年的随访检查中,对504名个体进行了血压(BP)测量和代谢组学分析,神经酰胺水平(d18:1,C24:0)与持续舒张压(DBP)变化呈正相关。此外,在自发性高血压大鼠(SHR)中也观察到了神经酰胺与高血压的关系,其中C16:0、C22:0、C24:1和C24:0神经酰胺是神经酰胺水平升高的主要原因。此外,降压治疗可能与降低神经酰胺水平有关。在中国,数十年来用于治疗高血压的中药钩藤可显著影响SHR中的神经酰胺水平,这表明神经酰胺可能是钩藤降压作用的关键效应因子。
糖尿病(DM)是血管损伤的另一个危险因素。越来越多的证据表明,神经酰胺在胰岛素抵抗和糖尿病并发症中起着特别重要的作用。在一项涉及男性和女性肥胖人群的研究中,每个性别被分为三组:正常糖耐量(NGT),糖耐量受损(IGT)和2型糖尿病(T2D)受试者。研究结果显示,与NGT相比,男性和女性肥胖者在T2D时肝脏总神经酰胺,特别是C16:0-Cer、C18:0-Cer、C22:0-Cer和C24:0-Cer显著增加。然而,在男性肥胖人群中,与NGT组相比,IGT组的总神经酰胺也显著增加。这与另一项研究发现C16-Cer水平在肥胖型糖尿病患者中较肥胖型非糖尿病患者显著升高相一致,表明C16-Cer在诱导胰岛素抵抗中起关键作用。在一项基于人群的前瞻性队列研究中,研究了基线神经酰胺与2型糖尿病(T2DM)的横切面和纵向关系,发现神经酰胺(C16:0, C18:0, C18:0/C16:0比值,C18:0/C24:0比值)与T2DM的流行有关,神经酰胺(C18:0, C18:0/C16:0比值)与T2DM的发生有关。急性冠脉综合征合并2型糖尿病(ACS- dm)患者的循环神经酰胺水平,包括Cer(d18:1/16:0)、Cer(d18:1/18:0)和Cer(d18:1/24:1)均高于急性冠脉综合征(ACS)患者。Pearson相关系数分析显示,Cer(d18:1/18:0)和Cer(d18:1/24:1)与空腹血糖水平有较强的相关性。在一项涉及29例妊娠期糖尿病(GDM)患者和63名健康对照者的病例对照研究中,GDM患者的C24:0神经酰胺浓度明显低于对照组。此外,神经酰胺与DM的关系也涉及动物疾病模型。肥胖型T2DM大鼠模型血神经酰胺水平明显升高,葛根芩连汤治疗可降低神经酰胺水平,改善糖尿病相关症状。此外,通过药理或遗传方法抑制神经酰胺水平已被证明可以改善肥胖动物模型中的胰岛素抵抗。这表明神经酰胺积累导致胰岛素敏感性受损。
高脂血症与28%的缺血性中风风险增加相关,仅次于高血压、糖尿病和吸烟,是中风的关键危险因素,也是改变中风风险的关键治疗靶点。肝脂肪变性(HS)通常伴有血脂异常。在一项评估青少年血浆神经酰胺与HS之间关系的研究中,观察到C14:0、C16:0、C18:0、C24:0 Cers与较高的胆固醇水平之间存在显著相关性。减肥手术与高脂血症的立即缓解有关。术后3个月和6个月,血浆总神经酰胺浓度降低,同时脂质水平降低。高脂饮食(HFD)喂养是引起高脂血症的常见方法。饲喂HFD的小鼠血清和肝脏神经酰胺浓度显著升高,且与血清甘油三酯、总胆固醇和低密度脂蛋白胆固醇水平的变化趋势一致。此外,雌激素缺乏诱导的高脂血症大鼠和实验性高脂血症小猎犬的神经酰胺水平升高。
除了上述常见的危险因素外,肝脏疾病可能是中风的一个未被认识或容易混淆的危险因素。非酒精性脂肪性肝病(NAFLD)是最常见的慢性肝病,约占总人口的25%。虽然NAFLD在具有主要卒中危险因素(如糖尿病、肥胖和高血压)的患者中更为普遍,但NAFLD与卒中之间的关系似乎与这些危险因素无关。有趣的是,有几条证据表明NAFLD与神经酰胺水平的变化有关。几乎所有神经酰胺种类在非酒精性肝纤维化(NASH, NAFLD的较晚期)中都显著增加。饮食减肥被认为是NASH治疗的必要条件。1年生活方式改变后,NASH患者体重减轻,血清神经酰胺水平显著降低,提示神经酰胺水平是NAFLD发展的重要因素。NAFLD期间肝脏神经酰胺代谢的失调也在实验动物模型中得到证实。在ob/ob小鼠(一种NAFLD转基因动物模型)中,神经酰胺的增加也与脂肪变性程度相关。在HFD喂养的大鼠中,肉豆蔻素(一种SPT抑制剂)逆转了体重升高和血清转氨酶,缓解了血脂异常,并显著减轻了肝脏脂肪变性相关病理。此外,ASM在NASH中被激活,ASM缺乏会对HFD或蛋氨酸-胆碱缺乏饮食介导的肝脂肪变性产生抵抗。
脑血管病不同类型细胞中的神经酰胺
大脑被认为具有高代谢需求,负责大约20%的身体氧气和葡萄糖消耗。葡萄糖和氧气供应到中枢神经系统是通过血流运输的,这使得一个健康的血管系统对正常的大脑功能至关重要。大脑中含有多种类型的细胞,它们共同维持正常的大脑生理功能,相关细胞损伤或功能障碍可导致脑血流异常和继发性神经损伤,参与脑血管疾病的病理过程。神经酰胺可能是脑血管疾病的潜在治疗靶点,尽管神经酰胺影响不同类型脑细胞功能的机制尚不完全清楚。因此,为了更好地了解脑血管疾病的发病机制,本节将总结神经酰胺与脑细胞功能关系的潜在机制,包括但不限于脑血管疾病(图2)。
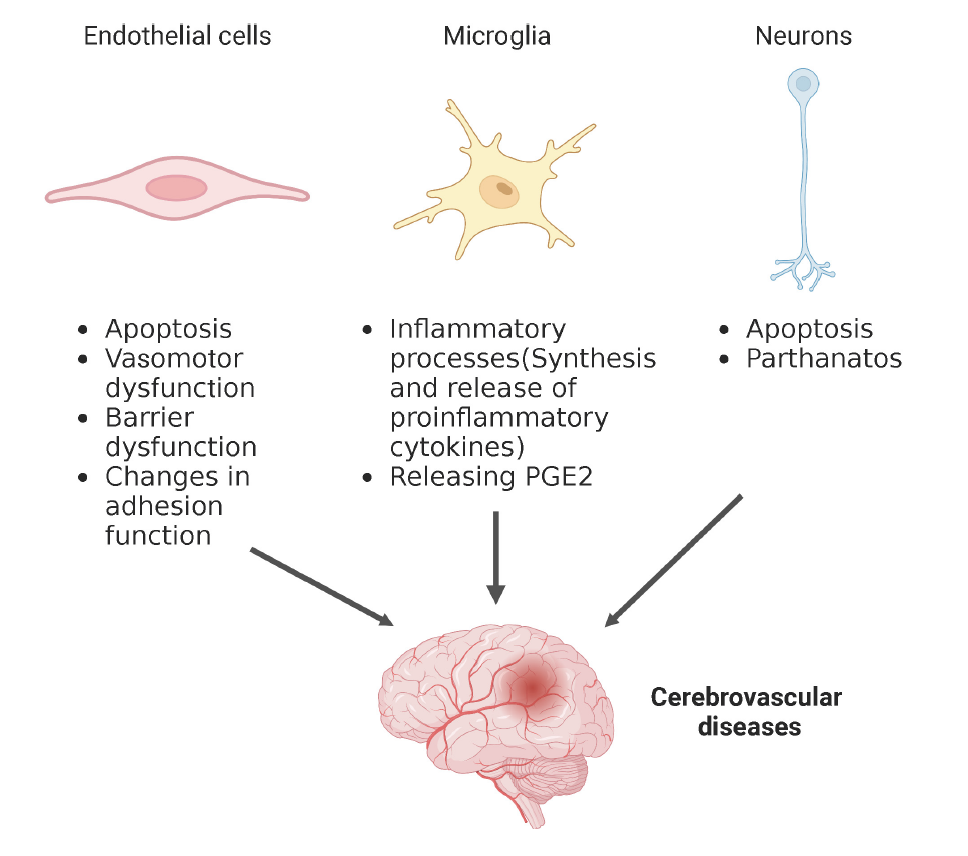
图2. 神经酰胺调节不同细胞类型影响脑血管疾病的示意图。
4.1.内皮细胞
内皮细胞是位于血管腔内表面的单层扁平上皮细胞。它们分布在大脑的大血管和微血管中,维持着正常的血管功能。内皮损伤,包括死亡和功能障碍,见于各种脑血管疾病,包括中风和CSVD,被认为是这些疾病发展的初始事件。内皮细胞死亡,主要是细胞凋亡,是血管功能障碍的直接原因。神经酰胺在体外和体内通过形成凋亡相关通路的脂质信号转导平台,直接诱导内皮细胞凋亡。近年来的研究发现,神经酰胺也以非凋亡的方式诱导内皮细胞损伤。
血管收缩功能的丧失可归因于内皮一氧化氮合酶(eNOS)活性和一氧化氮(NO)生物利用度的下降。eNOS对NO生成至关重要,其活性主要受苏氨酸494 (T494)和丝氨酸1176 (S1176)残基的磷酸化/去磷酸化控制。蛋白磷酸酶2A (Protein phosphatase 2A, PP2A)是一种神经酰胺活化的磷酸酶,可直接降低eNOS Ser1177残基的磷酸化,导致eNOS失活。研究表明,神经酰胺通过两种方式调节eNOS活性或NO的生物利用度。一方面,神经酰胺可以增加PP2A与eNOS的结合,降低eNOS与蛋白激酶B (Akt)和eNOS与热休克蛋白90 (Hsp90)之间的结合,然后PP2A促进与eNOS共定位的Akt的去磷酸化和/或直接使eNOS在S1176位点去磷酸化。另一方面,神经酰胺通过烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶依赖的方式产生氧化应激,增加ROS水平,可迅速破坏生物活性NO。神经酰胺对内皮屏障功能障碍影响的潜在机制可能取决于来自不同途径的神经酰胺。在损伤早期,神经酰胺水平升高源于ASM激活,导致钙内流增加和Ras同源基因家族成员A (RhoA)激活,导致典型瞬时受体电位通道6 (TRPC6)过表达,最终导致细胞骨架重排和细胞间连接破坏。在损伤后期,来自细胞旁细胞的神经酰胺有助于内皮细胞神经酰胺的重新合成,诱导细胞凋亡并导致屏障功能障碍。其潜在机制与硫氧还蛋白相互作用蛋白(TXNIP)/硫氧还蛋白(TRX)/凋亡信号调节激酶-1 (ASK1)/p38和c-Jun n-末端激酶(JNK)通路有关。此外,神经酰胺积累引起的内皮细胞屏障功能的破坏可能与封闭带-1 (ZO-1)和封闭带-2 (ZO-2)的降解有关,而封闭带-1和封闭带-2对于紧密连接的结构和调节功能至关重要。血液来源的免疫细胞可以进入大脑并引起局部炎症,导致血管自我调节功能丧失。在ASM来源的神经酰胺积累过程中,ezrin磷酸化增加,以及丝蛋白与细胞间粘附分子-1 (ICAM-1)在ICAM-1聚集时的相互作用,导致微绒毛形成增加,促进T细胞的跨内皮迁移。与上述研究不同,有两项研究揭示了神经酰胺对内皮细胞功能的积极作用。膜联蛋白A5是膜修复机制的重要组成部分。高糖处理是脑血管疾病的危险因素,可降低膜神经酰胺与膜联蛋白A5的关联,损害即时细胞膜重封(ICMR),促进血管炎症。神经酰胺也可能参与脑卒中恢复的调节。研究表明,抑制ASM/神经酰胺可诱导小细胞外囊泡(sev)的形成和释放,促进血管生成。血管生成的增加通过增加血脑屏障完整性、减少白细胞浸润和增加神经元存活进一步促进脑重塑。
4.2. 小神经胶质细胞
小胶质细胞作为驻留在大脑中的免疫细胞,是对脑血管疾病引起的病理生理变化作出反应的主要细胞。损伤区域的刺激因子如ROS、细胞外ATP和NO介导小胶质细胞的趋化和活化。小胶质细胞一旦被激活,就会释放炎症介质,影响神经传递,介导神经毒性,诱导细胞凋亡,直接影响行为和脑损伤。研究表明,神经酰胺参与了脑血管疾病时小胶质细胞的炎症反应。
细胞因子IL-1β是中枢神经系统内炎症过程的主要介质,由激活的小胶质细胞释放,其水平升高可加重脑损伤。神经酰胺不仅与IL-1β的产生有关,而且与IL-1β的分泌有关。神经酰胺对IL-1β生成的影响可能与调节NOD样受体热蛋白结构域相关蛋白3 (NLRP3)炎性小体有关,NLRP3是一种由NLRP3、凋亡相关斑点样蛋白(ASC)和caspase-1组成的蛋白复合物,通过产生IL-1β参与炎症反应。棕榈酸酯(PA)是一种脑血管疾病的危险因子,可诱导神经酰胺增加,随后在小胶质细胞中释放IL-1β。小胶质细胞暴露于新生神经酰胺合成抑制剂可显著阻止PA诱导的ASC斑点形成和IL-1b分泌。除了直接输出IL-1β外,小胶质细胞还可以通过微囊(MV)释放IL-1β。MV中含有的IL-1β可以将细胞因子运送到离供体小胶质细胞很远的地方,可能靠近靶细胞上存在的IL-1β受体,从而避免细胞因子在细胞外环境中的分散和稀释。炎症刺激诱导ASM易位到细胞膜外小叶产生神经酰胺,从而诱导含有IL-1β的MV出芽。前列腺素E2 (Prostaglandin E2, PGE2)能够诱导神经元凋亡,增加细胞内ROS水平,在脑血管疾病的病理过程中发挥重要作用。在神经元损伤期间,小胶质细胞对前列腺素(PG)的释放有重要贡献。环氧合酶-2 (COX-2)是合成PGE2的主要酶。神经酰胺可以直接激活p38丝裂原活化蛋白激酶(MAPK), MAPK参与提供mRNA稳定性和COX-2表达,从而释放PGE2,放大神经炎症事件。
小胶质细胞中的神经酰胺除了对神经损伤有不利影响外,还可能对脑卒中后的神经损伤有有益作用。脑缺血后,神经酰胺通过激活PP2A,上调细胞周期蛋白依赖性激酶(cyclin-dependent kinase, Cdk)抑制剂p21和p27,诱导小胶质细胞周期阻滞,从而阻止胶质瘢痕形成,减少炎症因子的释放。C2神经酰胺通过抑制ROS、MAPKs、磷酸肌醇3-激酶(PI3K)/Akt和Janus激酶(Jak)/信号转导和转录激活因子(STAT)通路,通过上调蛋白激酶A (PKA)和血红素加氧酶-1的表达,抑制脂多糖(LPS)诱导的小胶质细胞活化。Toll样受体4 (TLR4)表达于小胶质细胞表面,在激活核因子κ B (NF-kB)中起着至关重要的作用,而NF-kB又在小胶质细胞的促炎反应中起着重要作用。有趣的是,C2神经酰胺可以干扰LPS和TLR4的相互作用,从而抑制TLR4信号传导和随后的炎症。脑源性神经营养因子(Brain-Derived Neurotrophic Factor, BDNF)是神经营养因子家族的一员,参与神经保护、神经发生和神经可塑性,被认为是脑卒中后运动学习和康复的关键调节因子。一项研究表明,C8-神经酰胺通过蛋白激酶Cδ (PKCδ)和/或ε信号通路促进小胶质细胞BDNF分泌,从而加速脑卒中后修复。
4.3. 神经元
神经元对葡萄糖和ATP的缺乏高度敏感,在脑血管疾病中,它们是受血流不足影响的区域最先死亡的脑细胞。在缺血性脑细胞中,神经元损伤和死亡是神经功能缺损的主要原因。一些研究表明,神经酰胺对脑血管疾病的作用可能与神经元死亡,特别是细胞凋亡有关。有趣的是,神经酰胺可以诱导和保护神经元的凋亡。神经生长因子(NGF)缺失是神经元死亡的主要原因。细胞通过G1期和S期的进程,促进细胞凋亡,需要视网膜母细胞瘤蛋白(pRb)的磷酸化。相反,pRb的去磷酸化有利于细胞周期阻滞,从而抑制细胞凋亡。短链神经酰胺,如C6-神经酰胺,可以通过激活蛋白磷酸酶1(PP-1)来抑制NGF剥夺诱导的神经元凋亡,激活的PP-1可以防止pRb的过度磷酸化。另一种短链神经酰胺,C2-神经酰胺,已被报道可诱导神经元凋亡。这种效应与丝裂原活化蛋白激酶(MAPK)级联的差异调节有关。在MAPK级联反应中,p38是通过增加p38磷酸化参与神经酰胺诱导的细胞凋亡的必要激酶。除细胞凋亡外,神经酰胺还可能以一种新的方式诱导神经元死亡,即旁灭作用Parthanatos。Parthanatos,也被称为聚(ADP-核糖)(PAR)聚合酶-1(PARP-1)依赖的细胞死亡,其特征是PARP-1的过度激活,PAR聚合物的积累,以及线粒体的凋亡诱导因子(AIF)核易位,从而导致大DNA片段和染色质浓缩,最终导致细胞死亡。最近一项研究发现,神经酰胺可以诱导PARP-1过激活,增加PAR聚合物水平,促进AIF和迁移抑制因子(MIF)核易位,并通过增加ROS水平诱导DNA损伤和神经元死亡。
结论和未来展望
随着人口老龄化,脑血管疾病发病率急剧上升,给社会造成了沉重的健康和经济负担。脑血管疾病涉及不同的细胞类型、病因和信号过程,这使得其研究非常复杂。为了更好地了解脑血管疾病的病理生理机制和研究有效的治疗靶点,需要继续努力。在临床和基础研究中,有大量证据表明神经酰胺与包括中风和心血管疾病在内的脑血管疾病的进展和严重程度有关。神经酰胺在其他类型脑血管疾病(如颅内动脉瘤)中的研究很少。
然而,一些研究调查了神经酰胺与非脑血管疾病,如腹主动脉瘤的关系。在未来,神经酰胺可能成为多种血管疾病的潜在治疗靶点,包括但不限于脑血管疾病。一般情况下,内源性长链神经酰胺的积累伴随着脑血管疾病的进展,通过抑制神经酰胺从头合成途径或鞘磷脂酶活性来干扰神经酰胺的合成可能对脑损伤有益。脑血管疾病的发病机制涉及多种细胞类型,神经酰胺可能通过不同的下游信号通路影响不同类型细胞的反应。因此,需要深入研究神经酰胺在脑血管疾病相关的损伤和随后的神经修复过程中的特定细胞类型的具体作用。这将允许发现新的和突破性的治疗策略,用来改善可能由神经酰胺积累引起的脑血管疾病。



