重磅综述丨维生素D代谢与癌症关系
前言
维生素D,传统上被认为是一种必需的脂溶性维生素,可以从膳食获得,也可以经紫外线照射后在皮肤中合成,是固醇激素合成的前体,广泛调节人体的生理过程。维生素D的经典代谢路径是在肝脏和肾脏中经历两步代谢后生成一种具有生理活性的代谢物骨化三醇,它能够绑定维生素D受体(VDR)行使多种生理功能,经典的角色是调节骨重建中的钙和磷代谢。然而,近期的研究表明它也可以被一种CYP11A1驱使的非典型代谢路径代谢和激活。
皮肤缺少日照且膳食补充不足容易引起维生素D缺乏,且有研究表明这种缺乏会增加除了骨骼疾病外的其它疾病例如癌症的发生风险。首次观察到日照不足和癌症的发生和死亡率呈正相关关系是在80年前的北美。随后,在1980年和1992年,第一次有流行病学研究将低日光暴露和结直肠癌及前列腺癌的高发生率结合起来,这表明维生素D作为日照的一个替代物可以降低结直肠癌和前列腺癌的发生风险。从那以后,很多流行病学的研究都支持了涉及18种癌症的UVB-维生素D-癌症假说。这种假说随后被维生素D和癌症风险的直接相关性研究证实。此外,很多人群队列研究揭示了血清中的25-羟基维生素D (25(OH)D)水平和结直肠癌、乳腺癌、前列腺癌、胃癌及其它的一些癌症高风险呈负相关。而且,一些细胞和动物实验也为维生素D的抗癌作用提供了强有力的证据。因此,维生素D的缺乏能促进很多癌症的发生和进展,维持足够的维生素D水平有助于预防和治疗癌症。
既然诸多流行病学研究和实验数据表明了维生素D在预防和治疗癌症中的作用,那么人们对于骨化三醇和维生素类似物在临床中的应用也进行了研究。然而,过量使用维生素D引发的高血钙症限制了其在临床中的使用。而且,有足够的数据表明癌细胞通过几种方式降低骨化三醇的水平,导致其功能减弱和抗癌活性的降低。因此,研究维生素D在癌症中如何代谢及代谢失调有助于克服目前维生素D及其类似物在临床中应用中的限制。
维生素D代谢
维生素D作为一种激素前体需要代谢成具有生理活性的产物绑定到同源核受体上去实现其对不同生理功能的调控。
经典代谢路径
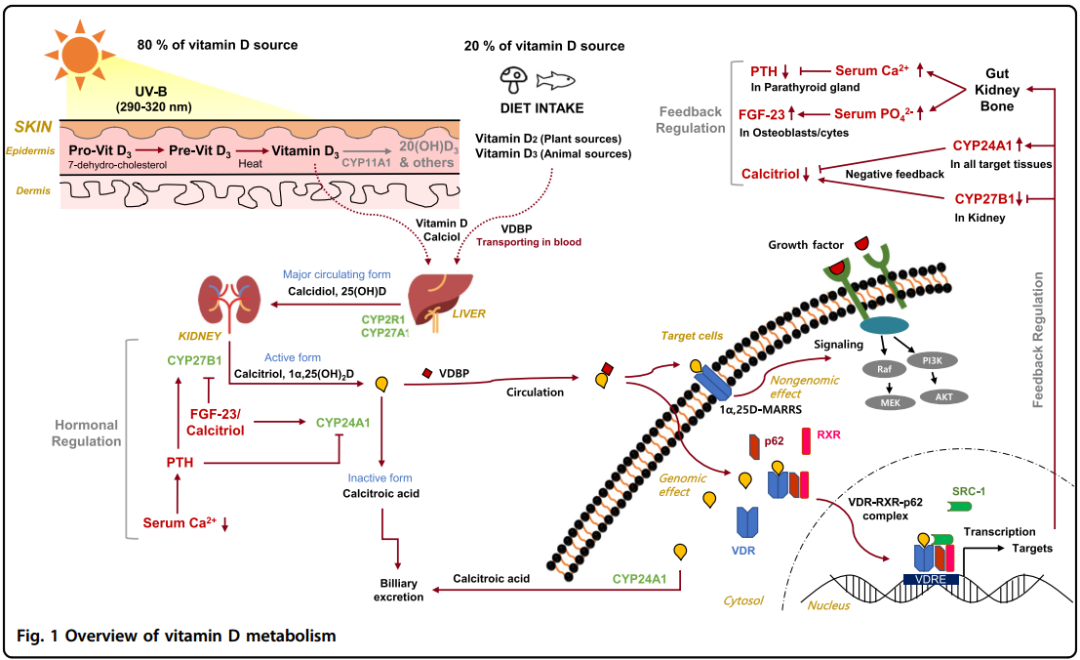
图1维生素D代谢概览
图1代表了维生素D的经典代谢路径。维生素D有两种主要的异构体,维生素D2(麦角钙化醇)和维生素D3(胆钙化醇)。维生素D2由植物、酵母、真菌中含有的麦角固醇经过紫外照射后合成,也可以从植物源性的食物例如蘑菇中摄入。维生素D3由表皮中的7-脱氢胆固醇经紫外照射后合成,也可以通过动物源性的食物例如鱼肝油中摄入。不管是从饮食还是皮肤中获得的维生素D2和维生素D3都要首先绑定维生素D-结合蛋白(VDBP)进入循环,然后再被运输到肝脏。
进入肝脏后,维生素D被25-羟化酶(CYP2R1和CYP27A1)代谢成25(OH)D(骨化二醇),25(OH)D是血清中维生素D的主要循环形式。25(OH)D随后被肾脏近端小管中的1α-羟化酶(CYP27B1)代谢成1α,25(OH)2D(骨化三醇),是维生素D最具有生理活性的成分。骨化三醇进入循环后和VDBP绑定后,被运输到肠、骨、肾脏等目标组织中,随后参与调节钙和磷的吸收、转移和重吸收。一旦生成,骨化二醇和骨化三醇的水平就会被25(OH)D
24-羟化酶(CYP24A1)严格调控,这种酶催化骨化二醇和骨化三醇的C-24和C-23位羟基化,24-羟基化路径产生代谢物钙三酸,钙三酸没有生理活性最终从胆汁排出体外,人们了解较少的23-羟基化路径则形成1,25-26,23内脂,这条路径中的CYP24A1催化活性表现出物种差异。CYP24A1羟化过程最终会使维生素D失去活性这个过程是在一个研究中被发现的。在这个研究中,Cyp24a1被敲除的小鼠表现出膜内骨受损矿化和高血钙症,导致了50%的小鼠死亡。有趣的是,在Cyp24a1和VDR都被敲除的小鼠中没有上述缺陷,表明骨化三醇的增加而不是24或23-羟基化维生素D代谢物的缺乏导致了这种缺陷表型的产生。
在目标组织中,骨化三醇绑定到VDR,VDR是配体激活转录因子核受体家族中的一种,会引起对各种下游生理功能的基因型和非基因型的调控。在基因通路中,骨化三醇绑定到细胞质VDR后,促使VDR磷酸化、然后和RXR形成异源二聚体,最后对复合物进行核转运。骨化三醇–VDR–RXR复合物绑定到目标基因启动子中的维生素D受体单元(VDRE)后招募转录辅助因子或辅助抑制因子去调节目标基因mRNA的表达,来调节不同的生理功能,包括钙和磷的代谢等。有趣的是,一项近期的研究表明自噬适配蛋白p62/SQSTM1通过在肝星状细胞中直接绑定VDR和RXR的方式影响VDR-RXR形成异源二聚体和对目标基因的招募。在非基因通路中,骨化三醇绑定到膜结合的VDR,这种VDR是一种快速响应的类固醇-绑定蛋白(1,25D-MARRS),这种作用随后会引发细胞信号通路的剧烈变化,包括钙和分裂素-激活蛋白激酶(MAPK)的信号通路,通过与细胞内信号分子间的直接蛋白-蛋白作用参与对某些表型功能的调控。
替代代谢路径
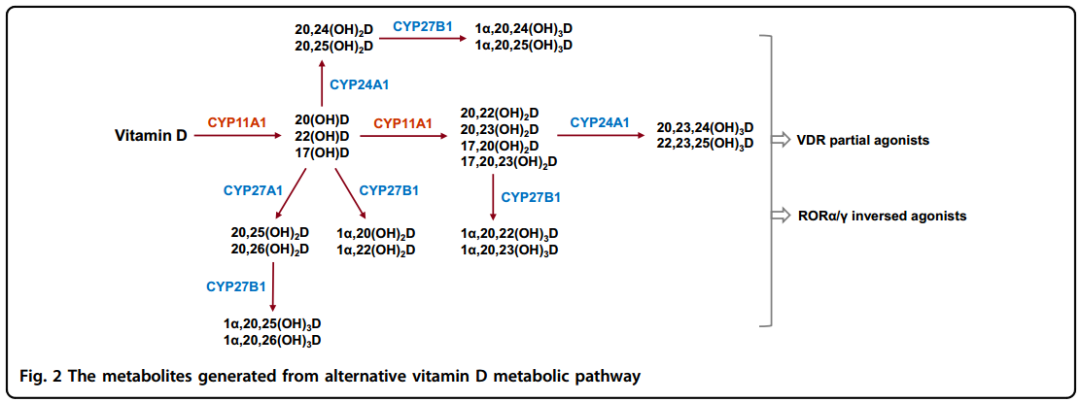
图2维生素D替代代谢路径
如图2,近年来在细胞色素P450侧链裂解酶CYP11A1参与下的维生素D的替代代谢路径被报道出来。CYP11A1最初是在类固醇的器官中催化类固醇生成的第一步限速酶,其原理是首先诱导C-22和C-20位的胆固醇羟基化,随后使C-20和C-22之间的键断裂产生孕烯醇酮(类固醇激素的常见前体)。那么是怎么发现CYP11A1是一个新的维生素D代谢酶的呢?研究发现CYP11A1在周缘组织例如皮肤和胃肠道中表达,维生素D可以替代胆固醇作为这种酶的底物。CYP11A1调节维生素D在C-20和C-22位发生连续羟基化,并且不会发生侧链的断裂。CYP11A1催化的单羟基化产物主要有20(OH)D、22(OH)D和17(OH)D。这些羟基化的产物会进一步被CYP11A1羟基化形成20,23(OH)2D、20,22(OH)2D、17,20(OH)2D和17,20,23(OH)3D。而且,这条路径的主要产物20(OH)D也能作为CYP27A1和CYP24A1的底物,CYP27A1作用下的羟基化位置是C-25或C-26,而CYP24A1羟基化的位置是C-24或C-25。在CYP27B1的催化下这些产物的C-1α位置还可以被羟基化产生三羟基化维生素D代谢物,这些代谢物不包括17,20,23(OH)3D,它是CYP11A1驱使的维生素D代谢终产物。总之,据推测这条替代的代谢路径能生成超过21种维生素D的羟基化代谢产物。
在CYP11A1催化的产物中,以20(OH)D和它的羟基化产物为例,它们在皮肤细胞中有与骨化三醇相当或者更好的诱导抗增殖、分化和抗炎的效果。而且,这些代谢物对紫外诱导下的DNA损伤和氧化应激表现出更强的防御机制,对一些相关细胞系有更好的抗癌特性。有趣的是,CYP11A1的产物,例如20(OH)D和20,23(OH)2D,对VDR有部分或偏向的抵抗作用。举个例子,这些代谢物在激活VDR的药物浓度水平上不会诱导血钙效应或者CYP24A1的表达,以上两种现象则在骨化三醇治疗比较常见。
除了VDR,类维生素A的受体α(RORα)和γ(RORγ)亚型-配体依赖转录因子核受体家族中的成员,也可以作为20(OH)
D和20,23(OH)2D新的受体。RORs参与调节很多病症例如癌症、自身免疫病和代谢异常中的免疫和代谢过程。有趣的是,CYP11A1衍生的维生素D代谢物可以作为RORα和RORγ的反向激动剂抑制其转录活性。举个例子,20(OH)D和20,23(OH)2D能够分别抑制RORα和RORγ目标基因Bmal1和G6Pase的转录。因此,维生素D的多效性和负面效应不仅归因于骨化三醇-VDR路径,也取决于CYP11A1衍生的维生素D代谢物-VDR或-RORα/γ路径。这一部分需要更多的工作来定义维生素D对健康和疾病的广泛影响。
经典维生素D代谢的激素调节
骨化三醇,作为一种激素,以一种负反馈机制紧密调节维生素D代谢中,使维生素D失活的酶-CYP24A1,是骨化三醇-VDR-RXR复合物最强的转录目标之一。CYP24A1的启动子包含2个接近转录起始点上游150和250-bp的VDREs,驱动骨化三醇对CYP24A1的强烈诱导。此外,通过招募组蛋白H4酰基转移酶和位于人类CYP24A1基因下游50到70-kb的RNA聚合酶II,骨化三醇也能诱导CYP24A1的表达。因此,肾脏中骨化三醇驱动的CYP24A1表达能紧密调节骨化二醇和骨化三醇的水平。而且,骨化三醇也通过对启动子区域的表观遗传修饰等复杂的机制抑制肾脏中CYP27B1的转录。
除了骨化三醇的负反馈调节,甲状旁腺激素(PTH)和成纤维细胞生长因子(FGF-23)两种激素也能调节维生素D代谢,这两种激素对维持钙和磷的稳态都有重要作用。PTH由甲状旁腺分泌对低血清钙浓度有响应,钙感受器受体(CaSRs)在甲状旁腺细胞表面被表达。PTH通过cAMP-依赖的转录增加或者上调核器官受体NR4A2-依赖的转录刺激肾脏表达CYP27B1。即使增加骨化三醇能诱导CYP24A1的表达引发其自身降解,PTH也能激活肾脏中的cAMP–PKA路径诱到mRNA中CYP24A1的降解使骨化三醇的水平得到维持。这种维持导致的高血钙水平能以一种负反馈调节机制通过绑定甲状旁腺中的CaSRs实现对PTH分泌的负反馈调节。FGF-23由成骨细胞和骨细胞分泌,对高血磷和高钙水平有响应。FGF-23抑制在肾小管近端顶端膜上的钠-磷协同转运蛋白2(NPT2)的表达促进磷的分泌,这种抑制通过绑定细胞膜中的FGF receptor–Klotho复合物实现。此外,FGF-23抑制肾脏中CYP27B1的表达同时刺激CYP24A1的表达使血清中的骨化三醇水平降低,然而这种机理目前还有待证实。
维生素D的抗癌性质
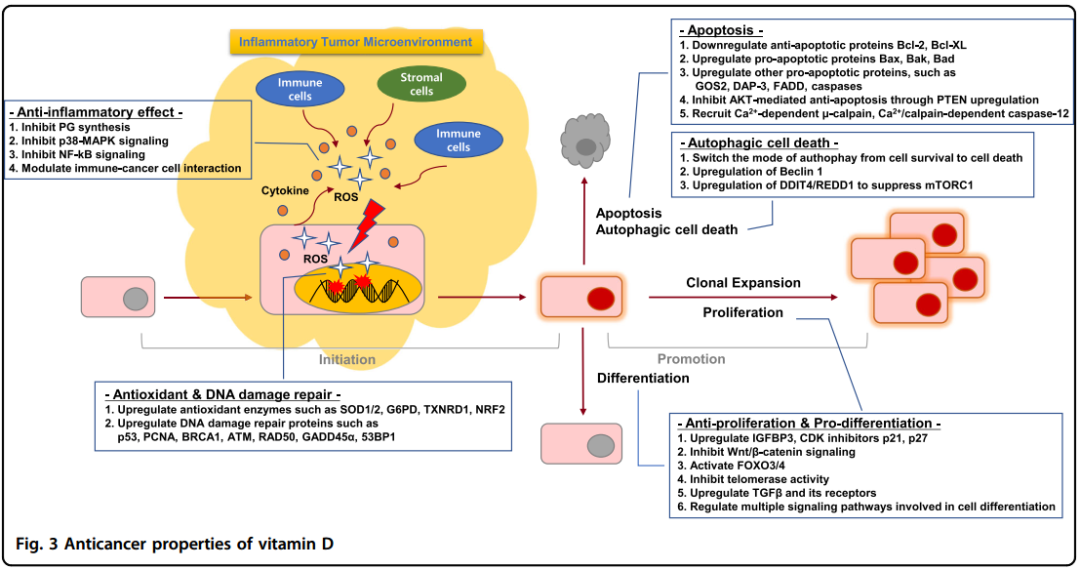
由于已经在流行病学和临床前研究观察到了维生素D在预防和治疗癌症方面的积极效果,人们也提出了很多机制来解释这一现象。有大量研究数据显示维生素D能够调节肿瘤发生的整个过程,从最开始发生到转移以及细胞-微环境的相互作用,如图3所示。这些机理包括调节细胞的行为,例如增殖、分化、凋亡、自噬和上皮到间质(EMT)的转变,以及调节细胞-微环境相互作用,例如血管生成、抗氧化、炎症和免疫系统。
 、
、
图3维生素D的抗癌性质
初始阶段:在抗炎、抗氧化和DNA损伤修复中的作用
肿瘤的初始阶段是一个在正常细胞中不可逆的基因突变过程,随后诱导了变化。很多数据表明维生素D在肿瘤形成阶段起到关键的阻碍作用,这种作用通过抗炎、抗氧化以及DNA损伤修复过程得以发挥。
抗炎
慢性炎症是一种低程度的长期响应,最终导致组织的逐渐破损并在活性氧(ROS)和炎症位点分泌的细胞因子的作用下进行修复。现在人们广泛意识到慢性炎症是导致肿瘤产生的一个主要因素。而维生素D通过至少4个机制发挥抗炎作用。
第一种机制是骨化三醇通过抑制环氧化酶-2(COX-2)和PG受体的表达以及促进PGs的降解抑制促炎响应的前列腺素路径。在前列腺癌细胞中,骨化三醇降低了COX-2及PG受体EP2和FP的表达,同时增加了15-羟基前列腺脱氢酶(15-PGDH-一个NAD+-依赖的负责PGE2降解的酶)的表达。此外,在乳腺癌的研究中表明,骨化三醇治疗后COX-2mRNA表达会减少和PGE2会增加的。在乳腺癌细胞系和卵巢癌组织中VDR的表达与COX-2呈负相关,支持了骨化三醇-VDR可以抑制COX-2表达和PGs生成这一观点。
第二种机制是维生素D可以抑制p38
MAPK调节的促炎症信号通路。在正常的前列腺上皮细胞和前列腺癌细胞中,骨化三醇诱导MAPK磷酸酶-5的表达抑制促炎症细胞因子例如IL-6的生成,这一过程阻止了p38
MAPK的磷酸化和激活。除了前列腺细胞,骨化三醇也能诱导人体单核细胞和鼠的巨噬细胞中的MKP-1,抑制脂多糖形成IL-6和肿瘤坏死因子(TNF)-α。
第三种机制是骨化三醇能够抑制核因子(NFκB)信号通路。骨化三醇抑制巨噬细胞中的AKT及其下游目标物1
IκBα的磷酸化,这种抑制通过上调THEM4(一种抑制NFκB的AKT调控蛋白)和COX-2的表达得以实现。在成纤维细胞中,骨化三醇增加了IκBα蛋白的稳定性,同时诱导VDR和IκBα酶的绑定,阻止其磷酸化和激活,最终抑制NFκB亚单元p65的核转移。
第四种机制是维生素D可以调节免疫和癌细胞之间的相互作用进而抑制促炎细胞因子的生成。外周血单核细胞和结直肠癌细胞培养基实验表明维生素D治疗可以显著降低促炎细胞因子例如TNF-α,
IL-6和低程度的IL-10的生成,支持了维生素D在肿瘤微环境中的抗炎作用这一观点。
抗氧化和DNA损伤修复
ROS在肿瘤发生的很多方面都起着重要作用,它能促进DNA突变、细胞增殖和细胞凋亡。因此,维持系统的抗氧化性是防止肿瘤进展的关键步骤。越来越多的数据表明维生素D能够促进抗氧化保护氧化应激导致的DNA损伤。研究表明在VDR敲除的小鼠结肠上皮细胞中由于氧化应激引发的DNA损伤有上升趋势。而且,用骨化三醇治疗的小鼠能显著降低丙二醛水平,丙二醛通常是脂质过氧化导致DNA损伤的终产物。日常补充维生素D可以减少过氧化导致的DNA损伤,这表明维生素D能够抵制过氧化应激导致的DNA损伤。
维生素D调节的对ROS诱导的DNA损伤的保护主要归因于其在抑制ROS解毒过程中大量酶的表达。研究发现,骨化三醇分别诱导前列腺上皮细胞中超氧化歧化酶1(SOD1)和雄激素敏感的前列腺癌细胞中超氧化歧化酶2(SOD2)的表达。此外,骨化三醇还诱导硫氧还原蛋白酶1(TXNRD1)的表达,这种酶会降低前列腺和乳腺癌细胞中硫氧还原蛋白的抗氧化功能,骨化三醇还会诱导葡萄糖-6-磷酸脱氢酶的表达,这种酶在前列腺和卵巢癌细胞中产生NADPH用于谷胱甘肽的再生。而且,NF-E2-相关因子2(NRF2),一个可以增加多种抗氧化剂酶的表达的转录因子,维生素D可以通过增加NRF2的表达、核转运或者减少KEAP1调控的降解来对其进行调控。由于NRF2是抗氧化酶的主要调节者,这可能也是维生素D能够诱导抗氧化酶和表现抗氧化作用的潜在机制。
除了通过放大抗氧化性来预防DNA损伤外,维生素D也能直接调节DNA的损伤修复过程。研究表明维生素D增加参与DNA损伤修复过程中的基因表达,例如p35、增殖细胞核抗原(PCNA)、乳腺癌细胞中的乳腺基因1(BRCA1)、PECs中的毛细管扩张突变基因(ATM)和招募DNA修复蛋白(RAD50)及鳞状癌细胞中的生长停滞和DNA损伤诱导α(GADD45α)。维生素D也能阻止由乳腺癌细胞中的溶酶体肽链内切酶半胱氨酸组织蛋白1酶调节的p53-绑定的蛋白1(53BP1)的降解。因此,维生素D一定程度上可以通过诱导抗炎、抗氧化和DNA损伤修复功能防止肿瘤初始阶段的基因突变。
进展阶段:在细胞增殖/分化和凋亡/自噬中的作用
即使细胞已经在初始阶段发生了基因突变,维生素D仍然能通过抑制细胞增殖、诱导分化和死亡来阻碍肿瘤进展进而发挥抗癌作用。
细胞增殖和分化
骨化三醇被证明在正常和癌细胞中均有阻止细胞增殖和促进分化的作用。而且除了骨化三醇,由CYP11A1催化产生的新的维生素D代谢物例如20(OH)D3、20(OH)D2、1,20(OH)2D3和20,23(OH)2D3都有通过VDR抑制细胞增殖和诱导分化的作用,作用效果与骨化三醇相当,但是对钙的影响更小。维生素D的抗增殖效果受到包括调节生长因子、细胞循环和信号通路在内的多种机制的调控。第一,维生素D增加了类胰岛素生长因子绑定蛋白3(IGF)和周期蛋白依赖激酶(CDK)抑制剂p21和p27的表达,同时抑制CDK2的表达,进而抑制IGF-1和IGF-2刺激的细胞增殖和细胞周期。第二,骨化三醇降低转录因子4-β-连环蛋白的形成或增加Wnt拮抗剂DKK-1的表达来抑制Wnt/β-连环蛋白信号通路。第三,维生素D也能激活转录因子FoxO3/4,它能够刺激细胞周期停滞和抗增殖的目标基因的转录,通过什么方式呢?通过诱导神经母细胞瘤细胞的去乙酰化和去磷酸化完成。第四,维生素D还能抑制端粒酶的活性,并且诱导转变生长因子(TGFβ)及其受体的表达进而抑制细胞生长。第五,维生素D能调节细胞分化中涉及的多个信号通路,例如磷酸酰基醇3激酶/AKT、MAPK、NF-kB和Ca2+信号通路。
凋亡和自噬
维生素D诱导的凋亡主要由抗凋亡蛋白Bcl-2和Bcl-XL的下调以及促进凋亡蛋白Bax、Bak和Bad的上调完成。此外,通过上调其它促凋亡蛋白例如GOS2、DAP-3、DAP-3和胱门蛋白酶也能诱导凋亡的产生。维生素D还能通过增加同源性磷酸酶(PTEN)的表达来抑制AKT调节的抗凋亡信号通路。最后,维生素D能通过招募Ca2+依赖的凋亡因子例如Ca2+依赖的μ-钙蛋白酶和Ca2+/钙蛋白酶依赖的细胞凋亡蛋白酶-12来激发凋亡过程。
自噬是一个在细胞生存和凋亡依赖的细胞死亡过程中有重要作用的分解代谢过程。有趣的是,大量数据表明维生素D能够将癌细胞中的自噬模式从细胞生存转向死亡。维生素能表现细胞毒性或者抑制细胞生长的自噬,而敏感的放射疗法通常诱导细胞保护的自噬。维生素D诱导的细胞自噬死亡过程归因于一种调节自噬的基因-beclin 1的上调。此外,CDK抑制剂可能包括在维生素D调节的细胞自噬死亡过程中,因为这种抑制作用通过失去p19得到增加或失去p27基因得到减弱。而且,维生素D也能通过诱导DNA损伤-诱导转录4(DDIT4)和调节发育和DNA损伤的基因(REDD1,一种抑制自噬的mTORC1抑制剂)的表达引发自噬。
癌症中维生素D活性的失调
前面提到,典型的骨化三醇的形成酶CYP27B1在肾脏中表达,调节骨化三醇功能和降解的VDR和CYP24A1在一些特定组织例如肠、骨骼和肾脏中表达。然而,除了以上组织,在其它部位也有表达,说明很多细胞都可以是维生素D的目标并且骨化三醇的水平能够局部调节以发挥精细的组织特异功能。重要的是,这种维生素D的局部调节作用在很多癌细胞中处于失调状态,这归咎于对基于维生素D的癌症治疗的抵抗。关于癌症中的维生素D代谢和功能失调的总结可见图4。
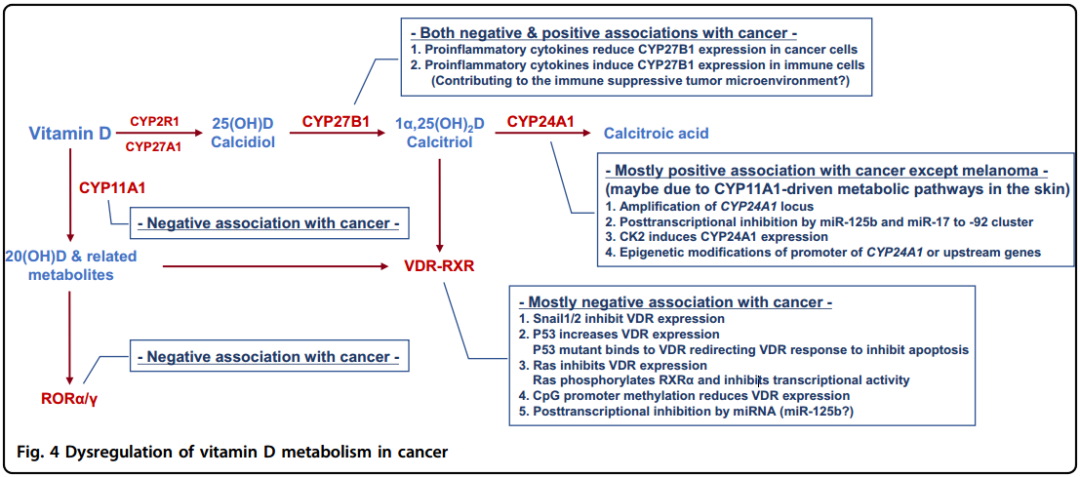
图4癌症中维生素D的代谢失调
VDR在很多细胞中都有表达,VDR-RXR通常与癌症发展呈负相关关系,在很多癌症中VDR的表达会随着去分化和肿瘤进展逐渐降低。
癌症的进展一般有五种方式影响VDR的表达。第一,转录抑制因子Snail在很多癌症中都会过表达,它们参与EMT、肿瘤侵袭和转移,对VDR的表达表现出抑制作用。研究表明Snail 1和Snail 2能够绑定到VDR基因启动子区域的E-boxes上,然后招募阻碍蛋白抑制结直肠癌和乳腺癌中的VDR转录。第二,肿瘤抑制基因p53,在近半数肿瘤中发生丢失或突变,能够增加VDR的转录。有趣的是,癌症相关的p53突变细胞能直接与VDR绑定调节VDR的响应,或者间接参与VDR调节的转录过程防止癌细胞凋亡。第三,很多癌症中的致癌基因Ras的连续突变会抑制VDR表达。人体结直肠癌中的K-Ras突变表达和小鼠结直肠癌及大鼠肠上皮细胞中的H-Ras突变表达能抑制VDR的转录从而抑制骨化三醇依赖的VDR的激活。除了降低VDR的表达,在角质形成细胞和PEC细胞系中分别有H-Ras和K-Ras的突变表达,它们通过诱导RXRα的磷酸化抑制VDR的转录。第四,癌症中也会发生VDR的表观遗传沉默。VDR启动子区域的CpG岛甲基化与结直肠和乳腺癌中的VDR表达减弱相关。乳腺癌细胞中的DNA甲基转移酶(DNMT)抑制剂诱导VDR的表达并且提高了骨化三醇的抗增殖效果。第五,有报道表明癌症中miRNA也参与VDR的表达。
CYP27B1
由于骨化二醇是维生素D的主要循环形式,与只依赖肾脏产生骨化三醇的细胞相比,能表达CYP27B1的细胞会进一步增加骨化三醇的局部浓度。与VDR类似,CYP27B1的表达也与肺癌、前列腺癌、结直肠癌、甲状腺癌和皮肤癌的进展呈负相关,表明在这些组织中骨化三醇的局部浓度可能对阻止癌症进展有重要作用。有趣的是,目前的研究表明,在结直肠癌中,促炎症因子IL-6和TNF-α使CYP27B1的表达下调,表明促炎症肿瘤微环境也是肿瘤进展中使CYP27B1表达下降的影响因素。但是,关于这种分子机制目前还不清楚。除了这些癌症中的负相关作用外,在甲状腺癌、乳腺癌和肾癌中观察到了正相关的结果。与肺癌不同的是,肺癌患者的肺泡巨噬细胞中的CYP27B1表达与癌症进展呈正相关关系。这个可以部分解释为在单核细胞、巨噬细胞和树突细胞中观察到促炎因子IFN-γ、TNF-α和TLRs使CYP27B1表达上调,表明促炎肿瘤微环境可能增加哺乳动物细胞中CYP27B1的表达。这种免疫细胞中CYP27B1表达的变化和维生素D代谢的关系可能有助于免疫-抑制肿瘤微环境。
CYP24A1
已知CYP24A1是一种可以降解骨化二醇和骨化三醇的酶,那么癌细胞可能通过上调CYP24A1的表达来降低骨化三醇的局部浓度,这中关系类似很多癌症中CYP27B1的降低。在大多数研究中,的确表明CYP24A1的表达与癌症进展呈正相关,其中黑色素瘤是个例外。
尽管CYP24A1表达是由骨化三醇-VDR通过负反馈调节诱导的,癌细胞中高水平的CYP24A1表达不太可能由VDR激活介导,因为在很多癌症中,VDR的表达和活性都发生了下调。这说明很多癌症中CYP24A1的过表达不是骨化三醇-VDR机制的调节结果。目前已经有4种机制被提出来。第一,乳腺癌和一些其它癌症中的CYP24A1过表达与包含CYP24A1基因染色体的扩增有关。有趣的是,只在肿瘤组织中观察到CYP24A1的扩增,良性组织中则没有,说明CYP24A1导致的骨化三醇失活可能是肿瘤状态进展的关键因素。第二,癌症中的CYP24A1过表达与miRNAs的转录后调控相关。第三,丝氨酸/苏氨酸蛋白激酶2(CK2)信号通路抑制前列腺癌中的CYP24A1过表达。有趣的是,CK2在很多癌症中都会发生过表达,并且通常与不良预后相关。第四,表观遗传调节CYP24A1启动子区域也会促进癌症中CYP24A1表达的改变。
在皮肤细胞中,CYP11A1驱动维生素D的替代代谢路径,CYP24A1能产生抑制维生素D代谢的产物而不是降解骨化三醇。有趣的是,CYP11A1产生的20(OH)D可以被CYP24A1羟化后形成20,24(OH)2D和20,25(OH)2D,这两种二氢化物与骨化三醇和20(OH)D对黑色素瘤有更好的抑制效果。与此相一致的是,20-羟化维生素D代谢物受体RORα/γ的表达与黑色素瘤的进展呈负相关并且有良好的预后。这些研究表明,激活维生素D的替代代谢路径可能是肿瘤治疗的一个新策略。
基于维生素D的癌症治疗
虽然缺乏随机的临床实验数据,很多流行病学、临床、临床前和体外实验数据表明激活维生素D信号是癌症预防和治疗的有效策略。而且,很多基于维生素D代谢的激活或活性失调的干预治疗已经被研究用于癌症治疗。然而,治疗策略中有些潜在的缺陷还有待改善。
系统性激活维生素D信号的一个潜在危险是有很高的概率引发高血钙症,这能导致很严重的身体损伤。为了降低这种副作用,研究者努力开发基于VDR的抗结剂,与骨化三醇相比在维持抗癌活性的同时减小引发了高血钙症的几率。直到现在,已经测试了约有1500种维生素D类似物,只有很少一部分被证明可以用于后续的白血病、乳腺癌、前列腺癌和结肠癌病人的临床评价中。作为CYP11A1主导的维生素D替代通路现在也被越来越多的了解了,但是对它在癌症和VDR及ROR中的功能还知之甚少。这条路径的研究将有助于开发癌症治疗中的新策略。此外,癌细胞中骨化三醇的局部浓度的增加是另一种可以避免产生高血钙症的策略。作为一种骨化三醇降解酶,CYP24A1在很多癌症中被过量表达,抑制这个酶可以增加癌细胞中骨化三醇的局部浓度。的确,目前的研究表明通过基因敲除或者药物的方式抑制CYP24A1的活性可以很大程度增加骨化三醇的抗癌效果。迄今为止,基于临床目的一些CYP24A1的靶向抑制剂已经被开发出来,这些抑制剂对癌症治疗是否有临床疗效和足够的安全性还有待临床验证。
此外,由于癌症进展过程中CYP27B1、VDR、CYP11A1和RORα/γ的表达会逐渐降低,基于维生素D的治疗效果可能局限在早期阶段。因此,定性和开发新的用于预测基于维生素D癌症治疗效果的诊断标记物可能是这种策略得以成功应用的不可或缺的部分。而且,深入研究癌症进展导致这些酶的表达降低的机制也是其中的关键步骤。正如前文提到,关于如何调控参与CYP27B1-VDR和CYP11A1-RORα/γ代谢过程的酶的表达的机制我们还了解的太少。目前的理解是很多癌基因信号通路通过调节相应酶的表达或代谢物活性覆盖了多条代谢通路。相应的,这些癌基因信号通路很大程度上调节维生素D代谢和功能相关的酶的表达和活性。揭开这种错综复杂的癌基因和维生素D代谢通路之间的关系需要对癌症中维生素D代谢和功能的失调有更深入的理解,也能对癌症治疗提供更有希望的策略。



