文献分享丨Trends Endocrinol Metab百家争鸣TMAO

TMAO是来源于肠道的代谢物,最近已成为心血管疾病和其他不良健康结果的潜在危险因素。然而,TMAO与慢性疾病之间的关系受多种因素影响,包括肾功能、肠道微生物和FMO3基因型。因此,TMAO是否是促进人类疾病发生和发展的诱因,或者只是一个潜在的病理标志仍然没有定论。重要的是,膳食来源的TMAO对健康有益,可以为许多生物功能提供起关键作用的营养素。提前饮食干预,将限制产生TMAO的营养物质作为改善人类健康的手段值得仔细考虑,目前可能并不合适。2016年Clara Cho和Marie Caudill在Trends in Endocrinology & Metabolism上发表综述文章“Trimethylamine-N-Oxide: Friend, Foe, or Simply Caught in the Cross-Fire?”。对TMAO的膳食来源、代谢、功能以及与疾病之间的关系进行了总结和讨论。
TMAO:一种与肠道菌群相关的代谢物
饮食与健康之间的关系涉及到营养物质、基因和生理系统之间复杂的相互作用,肠道菌群就是生理系统中重要的一部分。虽然人们很早就认识到肠道菌群在处理、合成和利用营养物质中的功能,但是肠道菌群是否有其他的功能,是否能影响诸如心血管疾病、肥胖和癌症等慢性疾病的易感性还不清楚。潜在的机制涉及微生物从食物产生的三甲胺(TMA)和TMA在肝脏中的代谢产物TMAO。最近有证据表明TMAO可以作为心血管疾病的预测因子。除了肠道菌群,肾脏功能和遗传也是可以影响血液中TMAO浓度的重要因素,它们可以影响TMAO与疾病之间的关系。
TMAO的膳食来源
TMAO本身存在于我们的食物之中,比如鱼肉,或者可以由肠道代谢胆碱和肉碱生成。在这些饮食来源中,鱼肉中的TMAO对循环系统中的TMAO浓度影响最大。食用鱼肉后会导致血液和尿液中TMAO浓度显著升高。循环系统中TMAO浓度也受食物的形式和量的影响。人类摄食大量的游离形式的胆碱,而不是磷脂酰胆碱,会导致尿液排出过多的TMA和其衍生物。值得注意的是,食用蛋类和补充胆碱导致的循环系统中TMAO变化在个体之间差异较大,表明饮食和宿主之间有强烈的相互作用。高脂饮食是影响TMAO浓度的另一个因素。在健康正常男性中,高脂饮食导致TMAO浓度升高。此外,摄入过多的热量(> 1000千卡/天),高脂肪(55%)4周会导致空腹血浆中TMAO升高。导致这一变化的具体机制还不清楚,但是部分原因可能是摄入食物中含有过多的肉碱和胆碱。
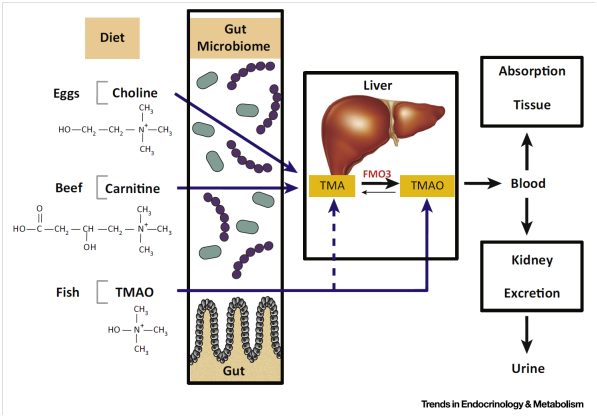
Figure 1. A Simplified Diagram of Trimethylamine-N-Oxide (TMAO) Generation and Metabolism
TMAO代谢
作为TMAO前体物质的胆碱和肉碱首先必须在肠道内由肠道细菌转化为TMA。抗生素处理后会抑制胆碱和肉碱摄入后导致的TMAO浓度升高。类似地,给无菌小鼠定植产生TMA的细菌会降低血液中胆碱的浓度。胆碱由微生物转化为TMA需要胆碱TMA裂解酶催化,这是一种由Cut基因簇编码的甘氨酸自由基酶,其存在于三个肠道细菌门:厚壁菌门、变形菌门和放线菌门。肠道菌群产生的TMA在肝脏中由FMO3进一步催化形成TMAO,生成的TMAO在24小时内主要从肾脏排出。
有意思的是,长期的饮食习惯可以改变肠道菌群的构成,最终影响利用食物产生TMAO。尽管受饮食调节,粪便微生物组成分析揭示了肉食和素食两种不同饮食模式的肠道菌群间存在差异,TMAO高组以普雷沃氏菌属而不是拟杆菌属为主。因此,长期的饮食习惯看起来会影响细菌类群,这可能反过来影响TMAO的产生能力。与饮食中的TMAO前体相比,人类和大鼠中多数TMAO似乎以一种独立于肠道微生物的方式被吸收。最近一项研究表明循环系统中TMAO在鱼肉摄入15分钟后会升高,这一时间窗太短,根本无法让肠道菌群转化和肝脏处理产生TMAO。
TMAO的功能
TMAO在许多物种和组织类型中具有一系列生物学效应。最为一个有机渗透物,TMAO被缺水生物体和组织用来维持细胞体积。哺乳动物肾脏积累TMAO来抵消尿素对大分子的去稳定作用,抵消尿素对配体结合功能的抑制作用。TMAO还可以抵消深海动物流体静压和热压对蛋白质结构和配体结合的不稳定影响。TMAO稳定蛋白的功能至少在某种程度上通过降低水的氢键结合能力,并作为拥挤分子通过排除体积效应增加折叠态的稳定性。TMAO还可以通过抑制肌肉蛋白中肌动球蛋白马达的活性来增强蛋白质的稳定性。
TMAO还具有“化学伴侣”的功能,在内质网中积累促进蛋白质折叠,从而抑制内质网应激和弱化非折叠蛋白反应。TMAO作为一种化学伴侣已被证实在啮齿动物模型中可以减少实验性糖尿病周围神经病变、哮喘和白内障的形成。此外,TMAO处理人类细胞系可以减少成神经细胞瘤细胞中的氧化损伤标志物,改善青光眼小梁网细胞中突变心肌蛋白的折叠和分泌,降低单纯性大疱性表皮松懈症患者热应激诱导的角蛋白聚集。
TMAO和慢性疾病风险
心血管疾病
TMAO与心血管疾病风险之间的联系首次在2011年报道。采用非靶向代谢组分析,研究者发现心脏病人血浆中TMAO浓度与心血管疾病风险之间存在剂量依赖性关系。一个加拿大的包括多民族人口的横断面研究发现血清TMAO与心血管疾病呈现分级相关性。血液中TMAO浓度也与心血管手术患者的冠状动脉梗死数相关,尿液中二甲胺水平与冠状动脉疾病相关。
TMAO导致心血管疾病的机制可能与巨噬细胞胆固醇过度累积有关。在ApoE-/-动脉粥样硬化易发性小鼠模型中,摄入TMAO和其食物中的前体均可以增加泡沫细胞的形成,这一过程依赖于肠道菌群来增加细胞表面表达两种致动脉粥样硬化清除受体:CD36和清道夫受体A。此外,TMAO随后被报道可以在ApoE-/-小鼠中通过下调肝脏CYP7A1活性来降低胆固醇反向转运。值得注意的是,在ApoE-/-小鼠中TMAO被发现可以降低过表达人胆固醇酯转移蛋白导致的主动脉损伤的形成,表明其对心血管疾病具有保护作用。TMAO导致心血管疾病的其他机制包括延长血管紧张素II的致高血压作用和增加血小板激活。TMAO是否在导致心血管疾病中具有中介作用,或者其高浓度只是与胆固醇代谢异常和循环系统紊乱共存的因素仍然还不确定。
肾脏疾病
循环系统中TMAO在慢性肾病中升高,与肾小球滤过率呈现负相关。循环系统中TMAO是影响慢性肾病病死率的独立危险因素。在中期和末期肾病患者中,高TMAO与全因死亡率呈正相关。TMAO浓度还可以用于识别出晚期慢性肾病患者中发生心血管事件最高的人群。尽管如此,最近一项研究对一系列心脏代谢危险因素,包括肾功能,进行分析,并没有发现TMAO、胆碱和甜菜碱血浆浓度与重大心血管事件风险存在任何显著相关性。
虽然TMAO加速肾脏功能损伤的机制并不清楚,但是饮食中含有过多的胆碱或者TMAO与小管间质纤维化和胶原沉积相关,并伴有TGF-β信号传导调节因子Smad3磷酸化增加。是否摄入生理相关水平的胆碱和TMAO可以导致肾小管间质纤维化和功能障碍仍不清楚。
2型糖尿病
TMAO水平升高也与2型糖尿病(T2DM)相关。糖尿病动物模型血液中TMAO浓度会比对照组高10倍。类似地,人类血液中TMAO也与T2DM相关。值得注意的是,T2DM似乎增强了TMAO和心血管疾病之间的联系。在T2DM患者中,高TMAO与多种心血管事件,包括心肌梗死、心力衰竭和不稳定性心绞痛的高风险相关。在没有糖尿病的受试者中,高TMAO只与死亡和心衰相关。类似地,T2DM患者中,高浓度TMAO伴随颈动脉内膜-中膜厚度增加、糖耐量受损、妊娠期糖尿病或体重指数>27 kg/m2,与年龄、性别和内脏脂肪量无关。
TMAO影响2型糖尿病的病理机制研究相对较少。高脂饮食中添加TMAO会使小鼠糖耐量受损更严重,肝脏胰岛素信号受到干扰和脂肪组织炎症发生。尽管如此,T2DM患者严重的心脏代谢风险也可能来自于与TMAO相关代谢途径的改变,包括脂类、磷脂和甲基化。
癌症
循环系统中TMAO升高与某些癌症风险增加有关。较高浓度的TMAO与缺乏维生素B12的绝经后女性患结肠癌的风险较高相关。此外,全基因组系统分析发现大肠癌和TMAO之间有很强的关联性,因为二者在遗传途径改变上有很多共同之处。最后,在前列腺癌风险的代谢组学分析中发现TMAO与恶性前列腺癌相关。
与疾病相关的重要TMAO调节因子
目前仍不清楚TMAO是否直接参与病理过程还是只是未知病理因素的一个标志物。此外,TMAO血浆浓度存在个体内差异,使得同一个人在不同时间测量的结果相关性不强,这会在纵向研究中给TMAO浓度和疾病终点之间的分析带来混杂因素。血液中TMAO浓度还受其他因素影响,包括肾功能、肠道菌群和FMO3活性和基因型。所有这些因素都可能在疾病病因和进展中有直接作用。
肾功能
肾功能下降是心血管病人死亡的常见原因,也是心血管疾病的危险因素。因此,肾功能是研究TMAO和心血管疾病之间关系的一个重要混杂因素。虽然肾小球滤过率被认为是评估肾功能的金标准,但是肾小球滤过率的估算并不十分准确,对早期肾病的诊断和进展的监测相对来说不够灵敏。因此,临床肾功能受损可能检测不到。此外,升高的TMAO浓度可以反应高血压导致的肾髓质受损。
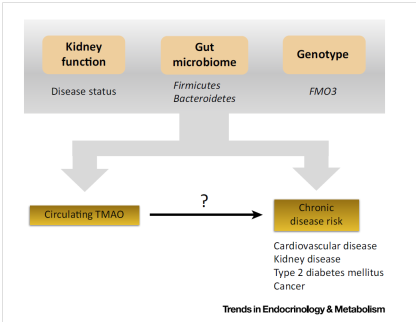
|
Figure
2. Overview of Factors that Can Influence the Relation between Trimethylamine-N-Oxide
(TMAO) and Chronic Disease Risk.
肠道菌群
目前有若干疾病状态与肠道菌群病理变化相关,啮齿动物模型研究表明肠道生态失调是导致疾病的重要原因。鉴于TMAO是来自于肠道菌群的代谢产物,循环中的TMAO浓度可能是肠道菌群组成的生物标志物。年轻男性在食用鸡蛋和牛肉后,血液中TMAO浓度升高,同时肠道菌群的生物多样性下降,厚壁菌门相对于拟杆菌门有更多的富集。值得注意的是,以TMAO升高为标志的肠道菌群组成变化可以导致疾病的发生和发展。宏基因组分析表明动脉粥样硬化患者柯林斯氏菌属丰度较对照组高。这些发现提出了一种可能性,即血液中TMAO的升高可能由肠道菌群失调导致,这可能是潜在的疾病致病因素。此外,循环中的TMAO可以反映疾病发展过程中肠道菌群组成的差异。无论哪种情况,TMAO都更像疾病的标志物而不是直接的病因。
FMO3活性和基因型
虽然FMO3催化TMA生成TMAO这一活性广为人知,但是它还可以调控胆固醇代谢和胰岛素敏感性。给FMO3敲低的小鼠喂食胆固醇会改变胆管脂类分泌,妨碍小肠胆固醇吸收,抑制肝脏生成氧甾醇和胆固醇酯。此外,在胰岛素抵抗小鼠中敲低FMO3会抑制FoXO1(一个重要的代谢调控因子),从而预防高血脂和动脉粥样硬化的发展。因此,FMO活性可以通过独立于TMAO的方式影响疾病的预后。
值得注意的是,FMO3活性的不同在人类中可以由FMO3不同的变异导致。除了罕见的三甲胺尿病人的FMO3突变,单核苷酸多态性导致的酶活降低也有报道。FMO3 E158K和E308G杂合子突变携带者缺血性中风的风险较高。E158K多态性也与高血压易感性和慢性肾病死亡相关。虽然FMO3活性调节因子和疾病风险之间的本质联系非常复杂,研究的也并不清楚,但是现有数据表明FMO3活性在疾病病理中起着重要作用,与TMAO代谢关系不大。
富含TMAO饮食的健康效应
长期以来人们认为吃鱼(含TMAO)与降低心血管疾病风险相关,富含胆碱和肉碱的饮食也对人类健康有益。此外,含有TMAO前体的动物源性食物也是重要的营养来源,比如omega-3脂肪酸、铁和维生素B12。
作为磷脂酰胆碱和乙酰胆碱的前体物质,胆碱在膜的生物合成和神经信号传递中起着重要作用。胆碱也是细胞内甲基化反应的甲基供体,包括DNA甲基化等。怀孕期间对胆碱的需求尤为重要,额外的胆碱摄入被证明可以通过表观遗传修饰和增强胎盘功能来降低新生儿的应激反应,从而降低婴儿神经管缺陷的几率。富含胆碱的饮食与健康希腊成人较低的血浆炎症标志物相关,富含胆碱饮食也可以提高人的认知功能。
左旋肉碱对能量代谢,尤其是脂肪酸氧化非常重要,补充肉碱可以作为一种增效剂。血液透析病人补充肉碱可以降低血管损伤标志物和氧化应激,包括可溶性细胞内黏附分子1、血管细胞黏附分子1和丙二醛,尽管这会导致血浆TMA和TMAO浓度升高。此外,荟萃分析表明补充肉碱可以降低死亡率。
结束语和未来展望
在病人和疾病动物模型中,TMAO是一个新的恶性心血管疾病危险因素。循环TMAO在其他疾病,包括肾病、2型糖尿病和癌症中作为危险因素也正在引起重视。人类中TMAO是否能直接引起疾病发生和发展,或者只是背后真正病理机制的一个简单标志物现在仍不确定。需要考虑的重要混杂因素包括肾功能、肠道菌群和FMO3基因型。富含TMAO前体的饮食可以为健康提供重要的营养物质。因此,因为容易升高TMAO就限制动物源性食物可能并不合适,反而会导致其他意想不到的不良后果。
临床研究降低TMAO对心血管疾病结局的效应时需要阐明TMAO在疾病过程中的作用。由于TMAO可以作为肠道菌群对人类健康不利反应的替代标志物,因此研究饮食和药物干预来恢复肠道菌群和宿主之间的共生关系非常有必要。最后,实验室研究是增强我们对TMAO和FMO3在人类器官系统中功能认识的保障。



