文献分享丨Cell Metab肿瘤与2-HG代谢流
前言
新陈代谢重编程是癌细胞的重要标志之一,代谢失调对癌症发生和癌细胞存活十分重要。然而,目前尚不清楚这些因素在多大程度上相互作用促进癌症的发生。这种重新编程的代谢已经被用于癌症的诊断、分期和分级,以及对肿瘤治疗的反应。
2-羟基戊二酸(2-HG)是多种癌症的生物标志物,是由于异柠檬酸脱氢酶(IDH1/2)突变导致的异常积聚,多种癌症都表现携带IDH1/2突变。2-HG通过抑制α-酮戊二酸(a-KG)依赖的双加氧酶和去甲基酶而与表观遗传学变化联系在一起。2-HG作为生物标志物在检测、诊断和治疗监测方面具有很大的潜力,但目前2-HG在体内的主要代谢来源尚不清楚,难以解释。
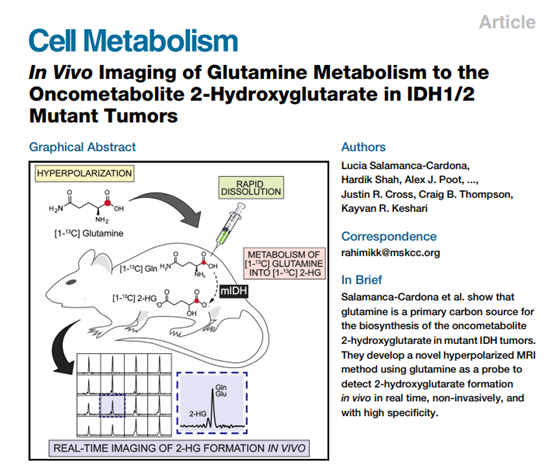
2017年11月,威尔康奈尔医学院Kayvan R. Keshari课题组在《Cell Metabolism》期刊上发表了题为“In Vivo Imaging of Glutamine Metabolism to the Oncometabolite 2-Hydroxyglutarate in IDH1/2 Mutant Tumors”的研究成果。该研究利用超极化磁共振成像(HP-MRI)技术展示了在IDH1/2突变型肿瘤中HP[1-13C]谷氨酰胺(Gln)快速代谢为HP 2-HG的体内实时成像,并用HP 2-HG无创性地检测到体内MIDH的特异性抑制。我们非常有幸邀请到深耕代谢组学的青年学者刘平辉,为我们带来这篇文章的全方位解读。原文链接:https://doi.org/10.1016/j.cmet.2017.10.001。
研究结果
体外培养的IDH1/2突变体中Gln流向生成2-HG
既往研究发现在胶质瘤细胞异位表达IDH1突变体实验中,Gln是形成2-HG的碳源。作者在不含Gln的培养基中添加[13C5]Gln培养JJ012和CS1两种细胞系,24h后两种IDH突变体中几乎所有总Gln和2-HG都被完全标记(m+5)(图1A)。JJ012和CS1两种细胞系在用[13C6]葡萄糖(Gluc)孵育24h后,均显示出极少量(约5%)的Gluc碳流入2-HG和Gln(图1B, 1C)。胞质IDH1突变体(JJ012)在不含GLn的培养液中未积累大量的2-HG,而线粒体IDH2突变体(CS1)细胞在该条件下仍然能够积累一定量的2-HG(图1D)。这些结果证实了在正常生长条件下2-HG的主要来源是Gln。
作者进一步用m+5代谢物进行实时测量,发现在体外Gln会分布富集成谷氨酸和2-HG(图2A-2D)。在JJ012和CS1中,GLn标记谷氨酸的速率分别为17.9±1.3nmol/百万细胞和16.0±1.4nmol/百万细胞;Gln标记2-HG的速率分别为1.90±0.08nmol和1.27±0.07nmol/百万细胞,2-HG产生的速率足够高,这也是为何肿瘤中发现2-HG积聚。作者猜想转化速率足够高,那可否利用HP GLn作为成像探针在体内进行检测。
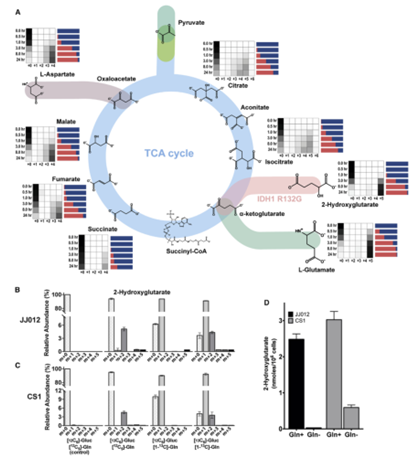
图1 在体外IDH1/2突变体中谷氨酰胺流向产生2-HG
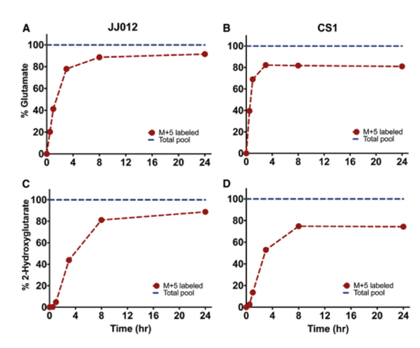
图2 Gln转化为谷氨酸和2-HG的体外动力学为体内HP-MR提供了可能
体外抑制IDH可调节GLn生成2-HG的动力学
为检测给定治疗导致的2-HG产生的变化,作者评估了在mIDH1模型中2-HG的产生是否可以在体外被调节。首先,作者确定了mIDH1抑制剂AGI-5198的特异性,JJ012细胞对该抑制剂表现出剂量依赖性的反应, 在3-5μm时对2-HG形成的抑制作用最高,IC50为0.21μm,AGI-5189对CS1细胞有轻微的抑制作用(图3A, 3B)。接着,作者试图确定在含2μM的AGI-5198与JJ012细胞共孵育96h后,抑制突变型IDH1对JJ012细胞中Gln生成2-HG动力学的影响。抑制作用不影响GLn到谷氨酸的流通量,但2-HG的生成减了大约70%,此显著差异可能大到足以通过体内的HP-MRI进行量化(图3C, 3D)。
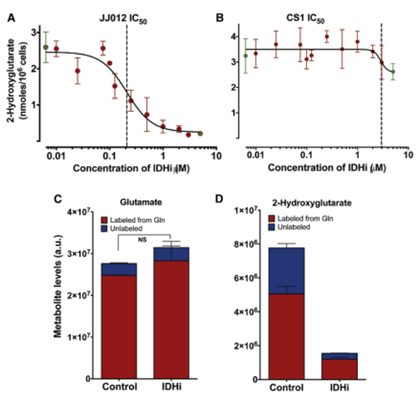
图3 mIDH1细胞中2-HG的产生速率可在体外使用mIDH1抑制剂药物进行调节
[1-13C]Gln的超极化及微量焦谷氨酸生成
Gln作为体内2-HG生成的成像探针有效性取决于所能达到的极化水平和T1弛豫时间,为了确定这两个参数,将[1-13C]Gln溶解在等摩尔量的NaOH中,并与OX063自由基甘油溶液混合。样品超极化>1h,溶解后即可极化水平达到34.7%±7%,T1为31±3s(图4B, 4C)。在溶液中,GLn会自发转化为焦谷氨酸(PG)。它们在生理pH下的13C NMR化学位移分别为174.7 ppm和180ppm,溶解后立即观察到少量的HP PG(图4D, 4C)。此外,作者发现C1 GLn的化学位移随pH漂移几ppm,为避免体内外结果差异产生的误导,当HP[1-13C]Gln样品溶解时需中和得到生理pH下的极化溶液。
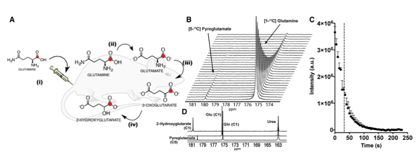
图4 [1-13C]Gln可在极少量PG形成的情况下超极化
通过HP[1-13C]Gln可在体内对HP[1-13C]2-HG的形成实时成像
根据此前体外模型中Gln转化为2-HG的动力学,作者假设2-HG的形成可能使用超极化[1-13C]Gln作为成像探针进行实时检测。测定了Gln在JJ012移植瘤中的转运动力学和2-HG的出现时间,Gln信号很可能是来自[1-13C] Gln和[1-13C] Glu的复合信号, [1-13C] 2-HG信号在24 – 27s之间出现,在30 – 33s之间达到最大值,在42s时消失。接着,作者利用动态采集的时间对两种肿瘤模型进行二维化学位移成像。图5A和5B显示了[1-13C] Gln+Glu(峰值为175ppm)信号在小鼠体内的分布,肿瘤区域内在180.8 ppm时可以观察到一个额外的峰值,将其指定为HP[1-13C]2-HG,而其他正常组织中没有该额外峰(图4D, 5A)。在JJ012和CS1肿瘤中观察到的180.8 ppm峰是源自于HP [1-13C] Gln探针的[1-13C] 2-HG。
为评估此方法是否反映了IDH1和IDH2突变体之间的动力学差异,将两种肿瘤细胞的HP 2-HG信号面积归一化,结果显示CS1的信号比JJ012的信号低34%; CSI和JJ012肿瘤中2-HG的浓度分别约为1.42±0.26 nmol/g 和2.15±0.17 nmol/g(图5C)。
使用HP [1-13C]Gln可在体内评估IDH1突变体的抑制作用
接着,作者使用HP [1-13C] Gln在体内评估AGI-5198对IDH1突变体的抑制潜力。测定了JJ012基线2-HG水平和基线光谱,两次注射HP [1-13C] Gln并使用mIDH1抑制剂进行治疗,与基线相比HP 2-HG信号显著下降约40%(图5D)。该方法能够评估Gln生成2-HG的体内调节,以及在单剂量给药后不久对抑制疗法的实时反应。
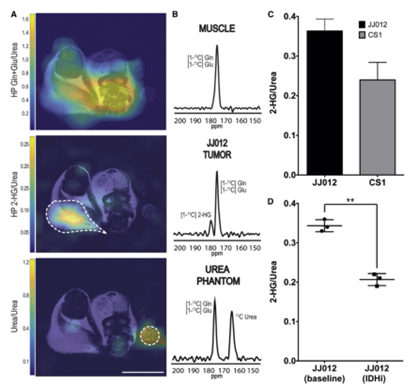
图5 利用HP[1-13C] Gln作为成像探针,在体内实时检测2-HG的形成
Gln在体内转化为2-HG的动力学促进HP成像
以上研究结果表明在用于HP成像时,Gln是2-HG的主要碳源,反应足够快可在体内用HP [1-13C] Gln检测到。为消除体外结果转化为体内成像的歧义,给肿瘤小鼠注射[13C5] Gln以确定2-HG的生成率。通过肿瘤组织的1H-NMR分析确定了2-HG在JJ012和CS1肿瘤中的总水平分别为6.2±0.6 Mm和4.7±0.6 mM,谷氨酸总水平分别为16.6±1.5 mM和13.5±2.6 Mm;LC-MS代谢示踪分析显示,在30min内,[13C5] 2-HG在JJ012和CS1肿瘤模型中分别累积了38.7±0.9 nmol/g和37.9±6.7 nmol/g(图6A-6C)。这些数据进一步证实了IDH突变体体内Gln代谢为2-HG的快速动力学。
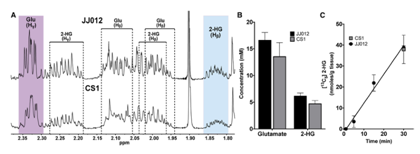
图6 Gln在体内转化为2-HG的动力学足够快可用于HP成像
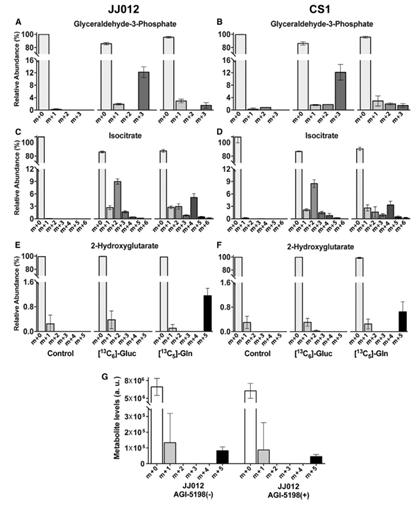
图7 葡萄糖碳在HP注射时间内没有进入2-HG
接着,作者试图将[13C6] Gluc标记的体外结果转化到体内,并验证观察到的Gln代谢表型是在HP成像所需的快速注射方案下形成2-HG的主要来源。为此,作者给肿瘤组织另外注射了[13C6] Gluc或[13C5] Gln。在JJ012和CS1肿瘤中,3-磷酸甘油醛m+3的增加以及m+2异柠檬酸进入TCA循环证实了[13C6]Gluc的代谢,[13C5]Gln的代谢分别在甘油醛-3-磷酸和异柠檬酸的m+3和m+4标记中得到证实(图7A-7D)。尽管[13C6]Gluc碳进入了TCA循环,但没有观察到2- HG的m+2标记,而来自[13C5]Gln的相对标记2-HG m+5达到了定量实验预期的水平(图7E, 7F, 6C)。这些体外研究证实了影像学实验中抑制作用研究的结果,并支持该研究检测潜在疗法疗效方法的可行性(图7G)。
总结
-
作者提供了证据支持Gln可能是2-HG的主要来源,并开发了一种非侵入性成像方法,利用HP-MR实时检测Gln中2-HG的活性形成。
-
通过同位素示踪证实了在表达IDH1/2突变的肿瘤细胞系JJ012和CS1中,2-HG主要由Gln通过谷氨酰胺分解而来。
-
胞内IDH1突变体在Gln耗竭条件下不积累2-HG,相同情况下mIDH2细胞仍然可以积累少量的2-HG,表明每种突变细胞的新陈代谢重编程存在根本差异。
-
Gln转化为2-HG速率足够高,可利用HP GLn作为成像探针在体内进行检测
-
通过HP[1-13C]Gln可在体内对HP[1-13C]2-HG的形成实时成像,还可评估IDH1突变体的抑制作用



