文献分享丨AP&T亚洲人群NAFLD研究

非酒精性脂肪肝(NAFLD)是慢性肝病的最常见原因,其亚型非酒精性脂肪性肝炎 (NASH) 与全因、病因死亡风险增加相关。研究发现含patatin样磷脂酶域 3 (patatin-like phospholipase domain-containing 3, PNPLA3) rs738409 C>G 和跨膜蛋白 6 超家族成员 2 (transmembrane 6 superfamily member 2 protein, TM6SF2) rs58542926 C>T 突变可导致 NAFLD 具有良好的心血管风险特征,但 NAFLD 相关基因突变对全因死亡率和病因死亡率的影响研究较少,尤其是在亚洲人群中还没有相关研究。为探究以上问题,复旦大学附属中山医院、复旦大学人类表型组研究院高鑫和夏明锋课题组,以及复旦大学附属中山医院、复旦大学生命科学学院、复旦大学人类表型组研究院唐惠儒教授课题组采用前瞻性人群队列研究方法,结合基因分型阵列和血清 1H NMR 代谢组学分析技术研究多个 NAFLD 风险等位基因对亚洲人群的全因和病因特异性死亡率的影响,发现PNPLA3 rs738409 C>G 突变及其与 TM6SF2 rs58542926 C>T 和 MBOAT7 rs641738 C>T突变的组合增加了超重或肥胖中国人群的肝病特异性死亡率,但降低了心血管死亡率。而血清 VLDL1 浓度降低是导致与 NAFLD 风险等位基因相关的肝病特异性死亡率增加的原因。相关成果于2021 年 12 月发表在《Alimentary Pharmacology & Therapeutics》上,文章标题为“NAFLD-related gene polymorphisms and all-cause and cause-specific mortality in an Asian population: the Shanghai Changfeng Study”。原文链接:https://onlinelibrary.wiley.com/doi/10.1111/apt.16772。
研究方法
(1)研究对象
纳入上海长风队列基线5581名参与者,使用Illumina Infinium BeadChip基因分型阵列(707180个标记物)进行基因分型,使用1H NMR谱进行脂蛋白及其亚类和小分子代谢物定性与定量分析。所有参与者的年龄均在45岁以上,平均年龄为63.7岁,BMI为24.2 kg/m2,糖尿病和代谢综合征的患病率分别为21.0%和39.8%。其中4645名参与者因同时具备肝脏超声检查和FIB-4指数(Fibrosis 4 Score)数据被纳入亚组分析,其中位肝脏脂肪含量(LFC)为 5.4%,脂肪肝患病率为 32.6%。
(2)相关定义
BMI>24和>28 kg/m2分别定义为超重和肥胖。SBP/DBP≥140/90 mm Hg,或有高血压病史,或使用抗高血压药物定义为高血压。糖尿病的诊断参照1999 年 WHO诊断标准,即空腹血糖≥7.0mmol/L,或口服葡萄糖后2小时血糖≥11.1mmol/L,或任何时间的血糖≥11.1mmol/L。高脂血症的定义参照2016 年中国成人血脂异常防治指南,TC≥ 5.2 mmol/L,或TG≥ 1.7 mmol/L,或使用药物治疗。代谢综合征的诊断参照NCEP ATPIII指南,即具有以下5种情况中的3种情况即可诊断:(1)腰围:男性≥ 90 cm,女性≥ 80 cm;(2)甘油三酯≥ 1.7 mmol/L,或使用药物治疗;(3)低高密度脂蛋白:HDL-C < 1. 04mmol /L (男) 或< 1. 29mmol /L (女),或使用药物治疗;(4)收缩压≥ 130 mmHg和/或舒张压≥ 85 mmHg,或使用药物治疗;(5)空腹血糖≥ 5.6 mmol/L,或餐后2小时血糖≥ 7.8 mmol/L,或使用药物治疗。脂肪肝基于超声检查,肝脏脂肪含量(LFC)超过 9.15%的临界值被定义为脂肪肝。酒精性脂肪肝的诊断根据既往史排除病毒、药物或其他原因所致的脂肪肝,超声检查LFC超过 9.15% 和过量饮酒(男性每周≥140克或女性每周≥70克)。02
研究结果
(1)NAFLD相关的基因突变
全基因组关联分析显示,PNPLA3 中的一系列基因突变与 LFC 密切相关,包括 rs738409 C>G 突变(图1A,P = 8.6 × 10-7),在调整年龄、性别和 BMI 后,纯合子 PNPLA3 rs738409 C>G 和 MBOAT7 rs641738 C>T突变和杂合子 PNPLA3 rs738409 C>G 和 TM6SF2 rs58542926 C>T突变与该人群的 LFC 增加显著相关(图1B-D)。进一步分析发现,PNPLA3 rs738409 C>G 和 TM6SF2 rs58542926 C>T 突变携带者表现出更严重的肝纤维化等级(p值分别小于0.001和0.005),但CH和TG显著低于没有 PNPLA3 或 TM6SF2突变的人群(表1)。而其他临床代谢参数,如体重、腰围、血压和血糖,在不同 PNPLA3、TM6SF2 或 MBOAT7 基因型携带者之间没有差异(表1)。
(2)NAFLD 相关的基因突变与全因死亡率和病因死亡率的关系
在平均随访 5.27 年(0.13-7.58年)后,5581个参与者的全因死亡率为816/10万人年,其中肝病死亡率为85/10万人年,心血管疾病死亡率为299/10万人年。排除患有其他已知慢性肝病后,肝病特异性死亡率为62/10万人年。表2显示肝病特异性死亡率从 PNPLA3 CC 基因型的43(14-101)/10万人年增加到 PNPLA3 GG 基因型的149(55-325)/10万人年(HR,3.41;95% CI,1.03-11.30),心血管死亡率从 PNPLA3 CC 基因型的371(268-499)/10万人年下降到 PNPLA3 GG基因型的174(70-359)/10万人年(HR,0.48;95% CI,0.22-1.07)。对于其他 NAFLD 相关基因突变,除了杂合 TM6SF2 rs58542926 C>T 突变携带者的全因死亡率(HR,0.58;95% CI,0.35-0.95)和心血管死亡率(HR,0.35;95% CI,0.13-0.97)降低外,TM6SF2 和 MBOAT7 基因突变与全因死亡率或病因死亡率无显着关联(表2)。
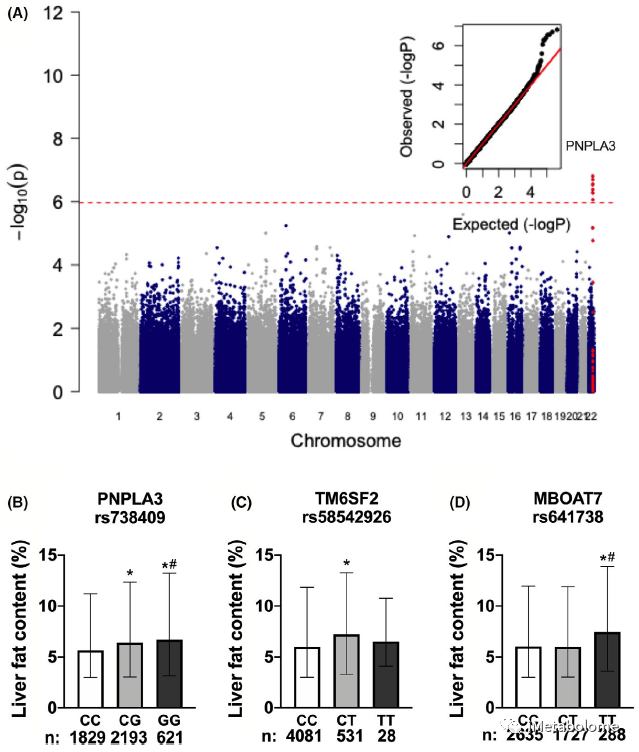
图1. 长风队列研究人群中的 NAFLD 风险基因突变
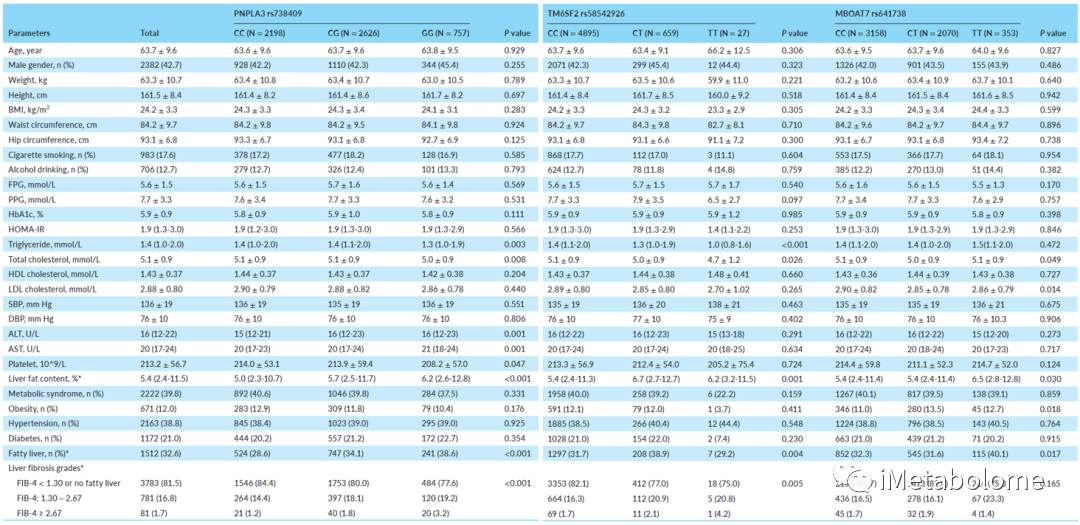
表1.研究人群的基线特征(N=5581)
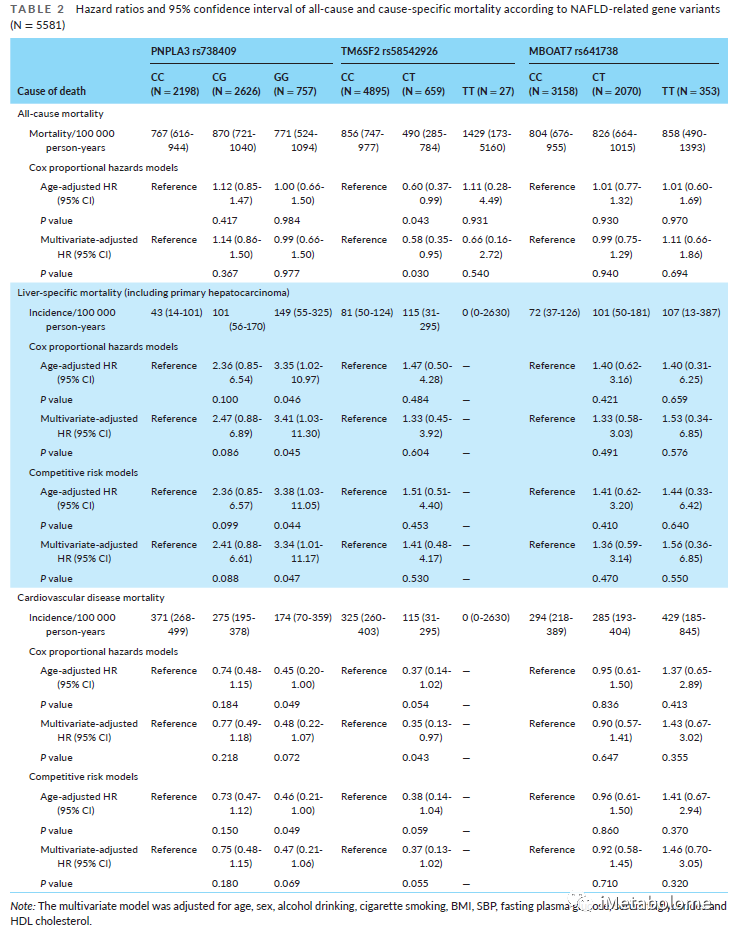
表2.NAFLD相关基因突变的全因和病因死亡率的HR和95%CI(N=5581)
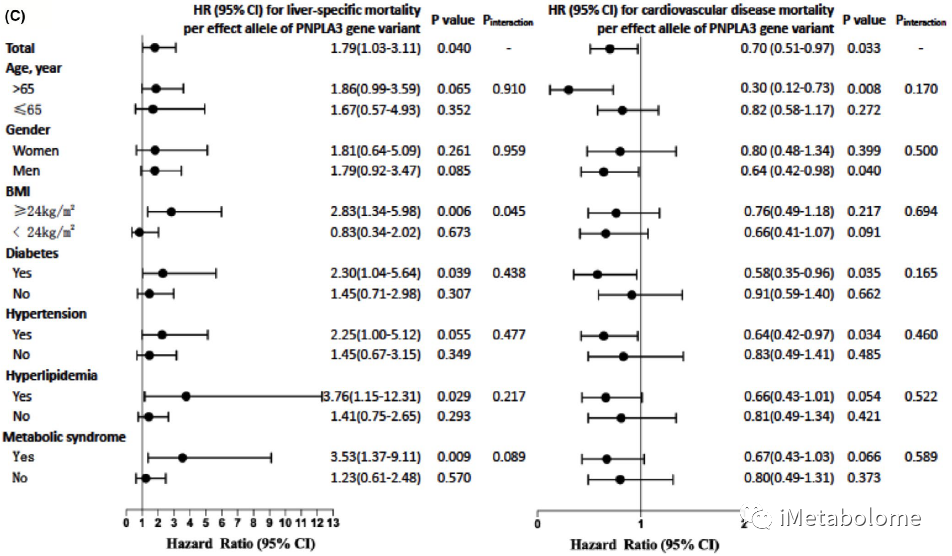
图2. PNPLA3 基因突变与肝病和心血管疾病死亡率
(3)肥胖与 PNPLA3 风险等位基因的交互作用促进肝病特异性死亡率
根据年龄、性别、BMI 和代谢综合征将研究人群分亚组后,PNPLA3 基因突变与肝病特异性死亡率的相关性在性别、年龄亚组之间相似,对肝病特异性死亡率的影响在 BMI ≥ 24 kg/m2、患有糖尿病、高血压、高脂血症或代谢综合征的人群中显著,而且肥胖与 PNPLA3 风险等位基因之间对肝病特异性死亡率的影响存在交互作用(Pinteraction=0.045)。PNPLA3 rs738409 C>G 突变与超重/肥胖人群的肝病特异性死亡风险增加约两倍有关(HR,2.83;95% CI,1.34-5.98),但在BMI正常人群中不显著(图2左)。在PNPLA3 风险等位基因携带人群中观察到患有糖尿病、高血压和 65 岁以上人群的心血管死亡率显著降低,但与肥胖或代谢紊乱之间没有交互作用(图2右)。

图3.基于BMI水平分亚组的与 PNPLA3 基因突变相关的血清脂蛋白
(4)VLDL1水平与超重/肥胖 PNPLA3 基因突变携带者的肝病特异性死亡率相关
PNPLA3 rs738409 C>G 基因突变与超重/肥胖人群的血清VLDL1和LDL2中的脂质成分减少显著相关(图3左),VLDL 或 LDL 中的任何脂质均与BMI正常人群的 PNPLA3 风险等位基因无关(图3右)。多变量调整后,VLDL1中的脂质减少与肝病特异性死亡风险增加有关,这种减少仅在超重/肥胖人群中观察到。这很好地解释了 PNPLA3 基因突变携带者的肝病特异性死亡率具有肥胖依赖性风险。
(5)PNPLA3、TM6SF2 和 MBOAT7 基因突变对病因死亡率的综合影响
在 3383 个 PNPLA3 rs738409 C>G 突变携带者中,只有 49.4% 携带单个 PNPLA3 突变,另外 45.4% 和 5.2% 分别携带2个和3个 NAFLD 相关的基因突变(TM6SF2 和/或 MBOAT7 基因突变)。根据 PNPLA3、TM6SF2 和 MBOAT7 风险等位基因计算 NAFLD 的遗传易感性评分,较高的遗传易感性评分表明 NAFLD 的遗传风险较高。图4显示经过多变量调整后,遗传易感性评分高的人群与肝病特异性死亡率显著增加相关(P for trend = 0.022),但心血管疾病死亡率显著降低(P for trend = 0.017)。亚组分析表明,具有 NAFLD 遗传风险的人群在存在肥胖、高血压、高脂血症和代谢综合征的情况下肝病特异性死亡率增加,且NAFLD 遗传易感性评分与肥胖和代谢综合征间存在交互作用(图4C)。此外,具有 NAFLD 遗传风险的人群仅在存在肥胖、糖尿病、高血压、高脂血症或代谢综合征的情况下显示心血管死亡风险降低(图4C,P均小于0.05)。血清脂蛋白分析显示NAFLD 遗传风险等位基因与超重/肥胖人群的总胆固醇、VLDL1 和 IDL 脂质成分的显著降低相关,这可能是导致高遗传风险的 NAFLD 人群的肝病特异性死亡率增加和心血管疾病死亡率降低的部分原因。
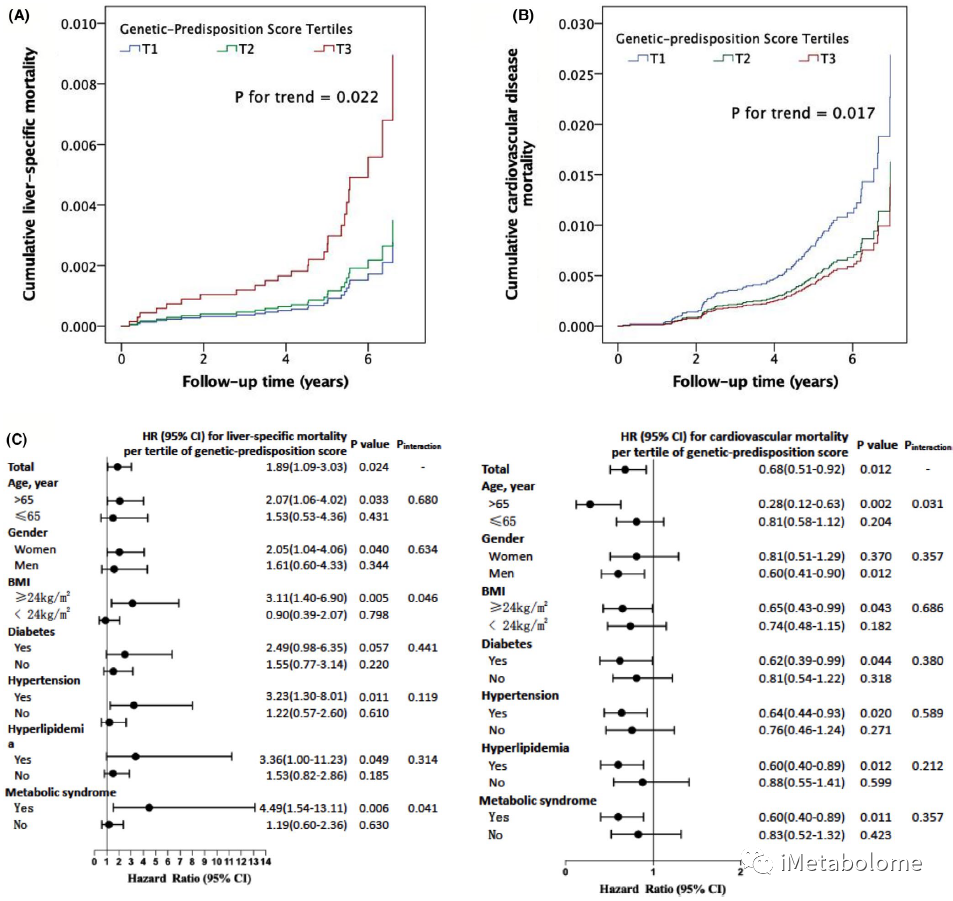
图4. PNPLA3、TM6SF2 和 MBOAT7 基因突变对病因死亡率的综合影响
(6)VLDL1-TG 的浓度决定有 NAFLD 遗传风险患者的肝病特异性死亡率
经过FDR多重校正后,血清 VLDL1-PL 和 VLDL1-TG 浓度与肝脏特异性死亡率呈现独立负相关(表3,FDR<0.05)。与 PNPLA3 CC 基因型携带者或 NAFLD 遗传易感性评分低的人群相比,PNPLA3 CG 和 GG 基因型携带者或 NAFLD 遗传易感性评分高的人群,如果他们的血清VLDL1-TG水平低于整个人群的中位值,则肝病特异性死亡风险高 3 倍以上;而血清 VLDL1-TG 水平高于中位值的人群,肝病特异性死亡率与PNPLA3 CC、CG 和 GG 基因型以及高和低NAFLD 遗传易感性评分间均无显著差异(图5)。
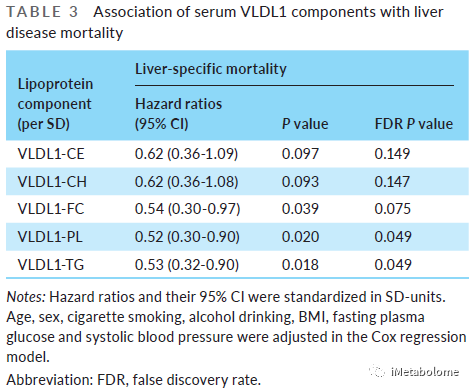
表3. 血清 VLDL1 脂质成分与肝病特异性死亡率的关系
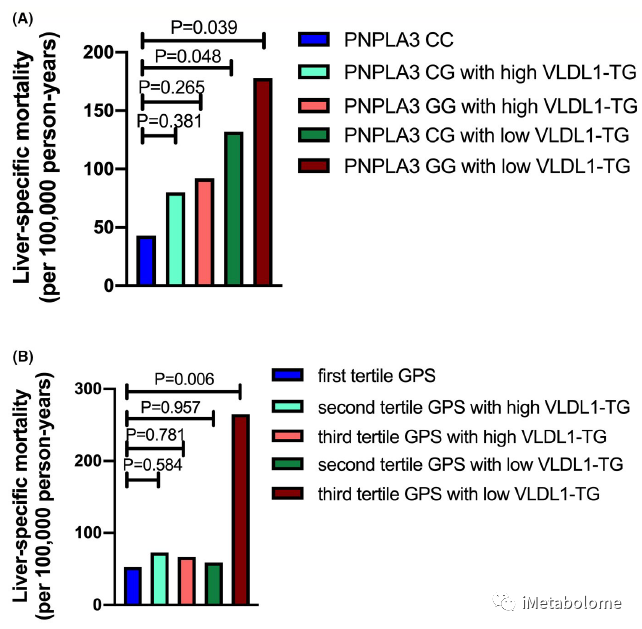
图5.基于 VLDL1-TG 浓度分亚组的NAFLD 遗传风险患者的肝病特异性死亡率
研究总结
PNPLA3 rs738409 C>G 突变与 NAFLD 遗传风险等位基因的结合预测中国汉族肥胖或代谢紊乱人群的肝病特异性死亡率较高,但心血管死亡率较低。因此,应特别注意具有高遗传易感性的 NAFLD 患者的肝病相关结局而非心血管结局。NAFLD 相关基因突变与肥胖的交互作用对肝病特异性死亡率的影响提示联合考虑 NAFLD 的代谢和遗传风险可能提高个体肝病特异性死亡率风险的预测可能性。
以上图文来源于iMetabolome微信公众号,原文链接:https://mp.weixin.qq.com/s/clCgroQF3Of1j8Zp-zHGfg?scene=25#wechat_redirect



