文献分享 | Front酮体在心血管疾病中的作用
尽管心血管疾病(CVD)在治疗方面取得了长足进展,但它仍然是全球范围内死亡的主要原因。先前的研究表明,心血管疾病与心脏能量代谢紊乱密切相关,靶向代谢的防治策略成为可用于开发心血管疾病的。β-羟基丁酸(β-HB)是体内浓度最高的酮体之一,曾被认为是一种有害、有毒的代谢产物,可导致糖尿病酮症酸中毒。然而,越来越多的实验和临床研究证据表明,β-HB这种小分子代谢物在心血管疾病中发挥多种功能。它不仅仅是一种“超级燃料”,也是一种发挥信号作用的代谢物。尽管β-HB在心血管疾病中的保护作用存在争议,许多研究人员仍然认为β-HB对心血管疾病的治疗潜力巨大。近期,邵巍、林东海和黄彩华等在Frontiers in Molecular Biosciences 发表了题为“β-hydroxybutyrate in Cardiovascular Diseases: a Minor Metabolite of Great Expectations”的论文,综述了β-HB在心血管疾病中作用的研究进展,旨在为开发基于代谢调节的心血管病防治策略提供理论依据。
MEM邀请第一作者邵巍副研究员对该文进行简要的解读。
Part 1 β-羟基丁酸的生物合成与利用
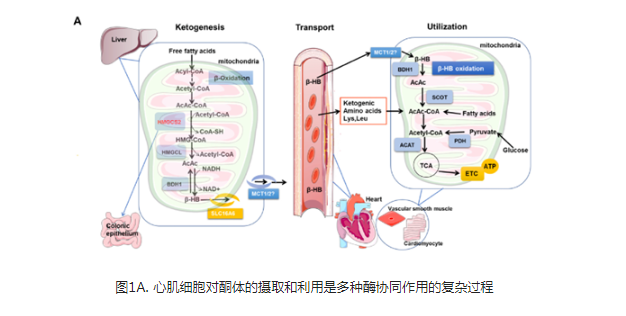
β-HB是一种含有两个对映体(R/D,S/L)的手性分子,是哺乳动物最丰富的酮体,对维持机体酮体水平的动态范围有重要贡献。β-HB的合成主要发生在肝脏线粒体基质和一系列酶中(图1A)。BDH1是一种核心酶,对β-HB合成的最后一步进行催化,可以引入手性特异性。由于BDH诱导的手性特异性,只有R-3-β-HB由正常代谢产生,并且容易分解为乙酰辅酶A和ATP。禁食、运动、热量限制、生酮饮食和其他导致内源性产生β-HB的方法可以产生R-3-β-HB,而不是S-3-β-HB。
HMG-CoA合成酶(HMGCS2;EC 2.3.3.10)是β-HB合成的关键性代谢酶。研究表明HMGCS2仅仅在肝细胞和结肠上皮细胞中显著表达和具有较高活性。然而,精确控制生酮率的分子机制仍有待详细研究。
虽然β-HB的合成主要发生在肝脏,但其利用主要发生在肝外组织。这是因为肝细胞具有合成β-HB的强大酶系统,但缺乏利用β-HB32的酶系统。尽管如此,肝外组织,如大脑、心肌、骨骼肌等,都有丰富而高效的酮体分解酶,可以分解酮体,再生乙酰辅酶A。此后,乙酰辅酶A被氧化以提供能量。此外,作为一种极性分子,β-HB易溶于水和血液。在血液中,β-HB可以运输到肝外组织,在那里它们主要经历末端氧化以促进TCA循环。
以往的研究表明,单羧酸转运蛋白(MCT)可以将β-HB转运出线粒体膜和肝细胞质膜。然而,与β-HB的合成和利用相比,对β-HB的转运知之甚少。单羧酸转运蛋白SLC16A6已被确定为从肝脏输出β-血红蛋白的必要转运蛋白。其他转运体是否促进β-HB摄取到靶组织或其细胞内运动需要进一步研究。β-HB也可以通过单羧酸转运蛋白1(MCT1)和MCT2转运到心肌细胞,然后进入线粒体。
Part 2 β-羟基丁酸在心脏能量代谢中的作用及其对心血管疾病的影响
心脏是高能耗器官,必须高速生成ATP,以维持收缩功能、基础代谢过程和离子稳态。有研究表明代谢灵活性是心脏能量代谢一个重要特征。在成人心脏中,ATP的生成来自各种循环底物,包括脂肪酸、葡萄糖、氨基酸、酮体和乳酸(图1B)。脂肪酸有助于心脏初级ATP的生成(>60%)。有趣的是,与脂肪酸相比,葡萄糖的消耗更少。乳酸仅占正常含氧心脏ATP生成量的5%左右。尽管可用性较低,但酮体(主要是指β-HB)和氨基酸也有助于心脏ATP的生成。
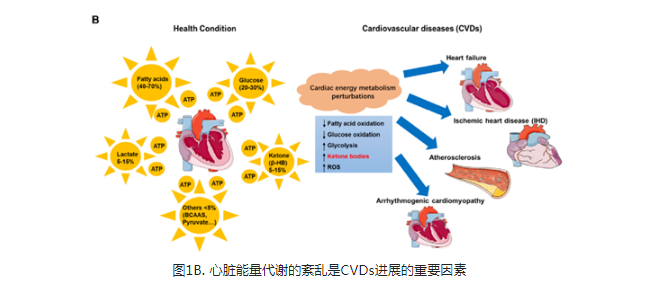
研究表明,心血管疾病的进展与心肌细胞代谢灵活性的丧失有关。能量缺乏在心肌细胞中很常见,这种代谢改变取决于疾病病理生理进展阶段。即使在早期阶段,结构性心脏病也会发生能量底物利用从脂肪酸转换为葡萄糖的情况。此外,能量底物利用的改变在心力衰竭(HF)的进展中也起着关键作用。有趣的是,在脂肪酸氧化减少的情况下,衰竭的心脏似乎对代谢进行了重新编程,以增加对酮体作为燃料来源的依赖。在病理重塑心脏(如高血压或心肌梗死)和糖尿病心脏中,酮代谢过程中消耗的用于ATP生成的O2比FAO17更有效。与FAO相比,酮体氧化的能量效率更高,每投入一个氧分子(磷氧比)将产生更多的ATP用以供能。此外,研究报道心律失常性心肌病患者的血浆中β-HB增加,同时心脏对酮体的利用率增加。在动物模型中,研究表明:在衰竭的小鼠心脏中,脂肪酸利用率下调,酮体利用率上调。因此,推测CVDs中心脏酮体代谢的增强是不良环境中心肌细胞ATP生成的有效替代途径。
Part 3 β-羟基丁酸在心血管疾病中的信号转导作用
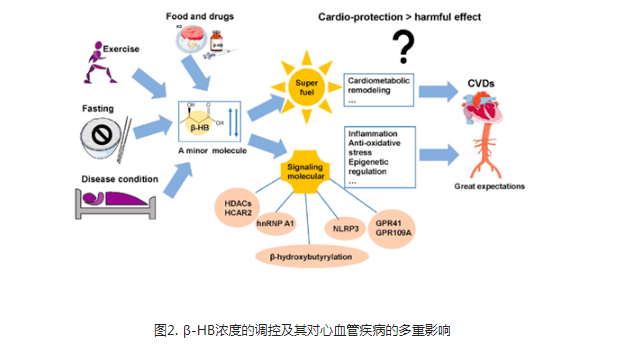
除了代谢作用外,β-HB也是一种信号代谢物,通过靶向不同的生物分子来调节细胞信号。在心血管疾病发生发展中,β-HB发挥重要的信号转导作用(图2),包括:与细胞表面受体结合;抑制组蛋白脱乙酰酶(HADC);作为蛋白质翻译后修饰的底物。众所周知,β-HB是G蛋白偶联受体(GPRs)的内源性配体。β-HB可特异性结合HCAR2并激活HCAR2以抑制脂肪细胞的脂解,这可能是调节酮体代谢的脂肪酸前体可用性的反馈机制。此外,β-HB在心血管疾病中的信号作用还涉及抗氧化应激和表观遗传调节。活性氧对心肌钙治疗具有负面的影响,通过促进肥大信号转导和凋亡诱导心律失常和心脏重塑。代谢介导的表观遗传调控是细胞信号的适应机制,也是表观遗传学的研究热点之一。β-HB可显著地增加组蛋白尾部的赖氨酸β-羟基丁基化,这是一种与空腹反应和肌肉分解代谢状态相关的表观遗传学特征。然而,β-HB参与的表观遗传途径的调控机制尚不清楚,是否有临床功能也需进一步深入研究。
Part 4 总结与展望
综上所述,深入研究心血管疾病中β-HB的作用及其机制,对于指导临床治疗具有重要意义。虽然目前的研究显示β-HB的优点远远大于缺点,初步的干预和观察性研究表明β-HB对心脏代谢有潜在益处,但相反的观点仍然存在。如一项早期研究报告称:在心肌细胞中,β-HB可同时抑制葡萄糖代谢和FAO代谢,从而损害心肌能量供应。此外,β-HB升高并不总是与CVDs临床预后正相关。有研究发现:与正常对照组相比,来自心房颤动患者的心房样本显示出酮体水平升高。循环中β-HB水平升高对心脏代谢的影响尚不完全清楚,需要进行更多的研究。此外,目前仍不清楚是什么调控机制使β-HB成为心血管疾病中的一把双刃剑。β-HB治疗CVDs的最佳时机和应用策略需要进一步探索。
以上图文来源于MEM医学与运动代谢研究园地,原文链接:https://mp.weixin.qq.com/s/pkmxLkroRks96dBOwVQx4Q



