经典重读丨Xenobiotica代谢组学开山之作
1999年,来自英国帝国理工学院的J.K. Nicholson教授在Xenobiotica杂志上发表了一篇综述性文章,文章标题是“'Metabonomics': understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data”,对其实验室多年来应用磁共振(NMR)方法研究药物毒性的成果进行总结和展望,首次提出了代谢组学(Metabonomics)的概念。
经过20多年的发展,随着检测技术的发展、分析仪器和软件性能的不断提升,代谢组学被广泛地应用于生物医学研究,逐渐成为当代生命医学研究中非常重要的技术方法。Jeremy Nicholson教授因其建立了系统的代谢组学研究方法,开辟了全新的研究领域,当选英国皇家医学科学院院士,更是著作等身获奖无数,在国际上享有"代谢组学之父"的称号。而这篇文章,更是达到了惊人4547次(截止日期:2022.06.09,数据来源google学术),成为代谢组学领域必引文献。今天,笔者带大家重新回顾一下见证代谢组学诞生的这篇经典论文。

|
引言
随着基于组合文库合成方案的应用,药物研发的快速发展给药物安全性评估过程带来了巨大压力。一旦有潜力的药物已经通过了初步生物筛选,需要在后续的研发流程中尽量降低候选药物的淘汰率。因此,发展新的兼顾有效性与安全性的分析技术将极大提高药物筛选的效率,从而有效降低淘汰率。目前的生物分析方法主要包括测量生命系统在遗传水平或者细胞蛋白表达水平对药物的反应,即所谓的基因组学和蛋白质组学方法。虽然现阶段基因组学和蛋白质组学方法价格昂贵且费时费力,但仍然是研究生物体对外源性化合物多层次应答的潜在有利工具。但是,即使整合基因组学和蛋白质组学仍然不能为理解生命体整体的细胞功能提供足够的信息,因为二者并不包括生命整体的动态代谢特征。因此,基于磁共振(NMR)的代谢组学方法的提出可以丰富和补充从遗传学和蛋白质组学层面所提供的有关生命体对外源化合物应答的信息。代谢组学(metabonomics)定义为“生命系统对病理生理刺激或者遗传改变的多参数动态代谢应答的定量测量”。这一概念的提出主要是基于过去二十多年来应用1H-NMR谱来研究生物体液、细胞和组织代谢物组成的相关研究(比如以下一些参考文献:Nicholson et al. 1983, 1985, Bales et al. 1984, Gartland et al. 1989, Nicholson and Wilson 1989, Moka et al. 1998)。另外,代谢组学研究中还使用模式识别(pattern recognition)、专家系统分析(expert system analysis)和相关的生物信息学工具来对复杂的基于NMR的代谢数据集进行解释和分类(Gartlandet al. 1991, Holmeset al. 1992, 1994, 1998a, b, Anthonyet al. 1994, Spraulet al. 1997, Beckwith-Hallet al. 1998)。代谢组学在代谢调控分析以及其他研究领域也有重要应用价值(Kacser and Burns 1973, Kacser 1993, Goodacreet al. 1996),需要说明的是有另外一个与代谢组学相关的概念,称为“代谢物组/metabolome”,其代表一个细胞内的全部小分子代谢物。相比之下,代谢组学侧重于检测、鉴定、定量和分类在整合生物系统中而不是单个细胞中代谢改变的动态变化过程。如此多维度的代谢轨迹才能真正反映在病理生理过程中正在发生的生物事件。在此,我们对基于NMR的代谢组学数据特点、毒理学分类和体内生物标志物的鉴定等方面的应用进行简要介绍。
药物毒性评估的基因组学和蛋白质组学方法
新的结构分子生物学工具的发展已经使得我们能更加深入地了解基因组的构成。随着基因测序和鉴定能力的提高,目前超过20种原核生物和线虫的全基因组测序已经完成。人类基因组包括大约8万个基因在未来几年内测序也会全部完成。“基因组学”(genomics)已成为分子生物学发生质变的重要概念之一,其本质是一种测量基因表达的半定量方法,这种方法在药物发现和毒理学评估中可以检测药物暴露后基因表达的变化。
目前应用比较广泛的基因芯片(gene chips)技术虽然价格昂贵,但是可以快速检测外源化合物暴露后很多基因表达的改变。然而基因表达与功能基因组学的关系仍然不是十分清楚,即使人类全基因组测序完成后仍然有很长的路要走,因为有大量的非编码DNA,复杂的基因之间以及基因和非编码DNA之间的相互作用。由于我们对基因表达变化所导致的生物功能变化还知之甚少,蛋白质组学(proteomics)应运而生。蛋白质组学研究主要半定量分析细胞蛋白对药物暴露和其他病理生理过程的响应(Anderson et al. 1996, Aicher et al. 1998, Geisow 1998)。多种方法可以用于蛋白质组分析,但是都需要将蛋白分离(比如二维胶电泳)和化学鉴定方法(主要是质谱)相结合。虽然蛋白质组学方法比基因组学方法成本要低,但是现阶段仍费时耗力。更为重要的是,虽然基因组学和蛋白质组学研究最后可能为毒理学机制研究提供新的见解,为新的潜在疾病生物标志物的发现提供帮助,但是现阶段将基因组和蛋白质组的研究发现直接和毒性分类指数相联系还十分困难。一个简单的原因就是现有的方法和技术并没有测量药物暴露后详细的随时间变化和多器官系统的反应,这对通过代谢改变来评价化合物的毒性来说至关重要,尤其当化合物的初级代谢发生在靶器官以外的其他位置时。比如一类化合物会在肝脏内形成谷胱甘肽的共轭化合物,接下来被β-裂解酶处理后生成活性中间体,而活性中间体最后的毒性靶器官是近端肾小管(Elfarraet al. 1986)。因此,发展新的方法可以对在体内、多器官的整体功能实时检测非常有必要。基于NMR的代谢组学方法恰好可以满足上述需求。
基于NMR的代谢组学
外源化合物可以与组织和细胞外成分发生复杂的相互作用,从基因表达到蛋白翻译甚至整个细胞的生化调控。在这种情况下,生物分子的组成会在多水平发生可以检测到的变化,“生物组/bionomics”是对所有这些变化的完整描述。有很多药物通过直接与遗传物质相互作用或者诱导药物代谢酶的合成产生毒性产物来发挥其毒性作用。在这种情况下,基因组和蛋白质组研究对药物毒性评估是有帮助的。但是,外源化合物可以只在药理水平发挥作用,并不影响基因的调控和表达,显著的毒理效应也可能与基因表达和蛋白质合成完全不相关。
饮酒可以在体内启动很多基因的表达,但是这并不能解释醉酒的原因。因此,在很多时候只考虑基因组和蛋白质组变化并不能有效地预测药物的毒性。但是所有药物诱导的病理生理紊乱可以导致内源性生化分子物质比例、浓度、结合力和通量失衡。如果失衡的强调足够大,毒性效应就会影响整个生命体的正常功能。代谢物在体液与细胞和组织内保持动态平衡,当有毒物质或者代谢刺激导致生命体组织内细胞过程异常时,就会影响生物体液的构成比例。在含有多种潜在干扰物的复杂基质中检测痕量的分析物是所有分析方法都会遇到的难题。因此,在生物样品中,比如血液、血浆、尿液、胆汁或器官样品,针对感兴趣的特定类型的分析物选择合适的分析方法至关重要。高分辨率1H-NMR波谱技术用于研究体液成分异常就非常合适,因为它可以不用做样品分离,不用做预判就可以同时定量多种代谢物。其他技术比如质谱也可以用于产生代谢数据,但是复杂样品中不同物质离子化效率的差异会影响检测和定量的准确性。NMR波谱还可以用于有效地筛选组织提取物和细胞悬液的代谢物轮廓异常。同时也有研究已经成功使用高分辨率魔角旋转1H-NMR波谱技术研究完整组织(intact tissue)的代谢物组成(Moka et al, 1998)。
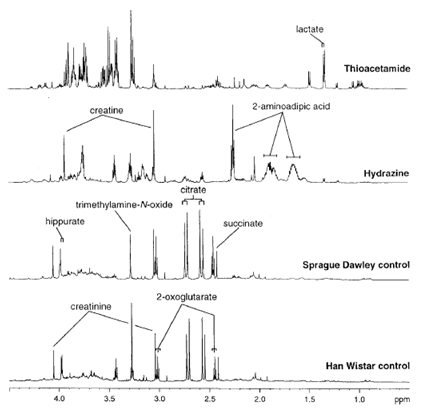
Figure 1.大鼠尿液的600 MHz1H-NMR谱图。
1H-NMR波谱技术检测内源性代谢物在体液内的精确分布模式受毒素类型和受试动物影响很大(Nicholsonet al. 1983, 1985, Baleset al. 1984, Gartlandet al. 1989, Nicholson and Wilson 1989)。不同类型的毒素会对体液中内源性代谢物的浓度和组成比产生特异性改变,这可以为研究毒理过程发生位置和基本机制提供信息。图一中所示的为有代表性的毒素处理后的大鼠尿液谱图。从生物分析方面考虑,产生这样的信息是非常高效的,每个样品只需要几分钟,不需要或只需要非常少的样品前处理。对照组的谱图看起来非常相似,但是不同毒素导致的代谢变化是不同的。因为几乎所有大类的代谢中间产物都有特异性的NMR谱图,所以该技术对指纹识别毒素导致的代谢紊乱非常有帮助。
因此,生物体液的1H-NMR波谱分析已经成功在大鼠研究中揭示了大量的器官特异性的代谢生物标志物,NMR作为分析生物化学技术在探索性方面表现卓越。比如氧化三甲胺、二甲基甘氨酸、二甲胺和琥珀酸可以提示肾乳头损伤,而在之前并没有有关肾乳头损伤的生化标志物(Gartland et al. 1989, 1991)。其他通过1H-NMR揭示的尿液标志物包括牛磺酸和肌酸分别与急性肝损伤和睾丸毒性相关(Nicholsonet al. 1989,Grayet al. 1990, Saninset al. 1990)。相似的方法还包括二维磁共振谱。生物体液NMR谱图中的生物标志物信息远比上述的要微妙和丰富,因为数以百计的化合物代表的很多代谢途径可以同时被测量,其代表对毒性刺激的整体代谢组学反应,可以更好的刻画病变特征。研究这些复杂的多参数数据最有效的方法就是将一维和二维NMR谱与模式识别方法相结合。
NMR代谢组学数据的模式识别和专家系统分析
组织和生物体液一维和二维NMR谱的复杂性是理解其中生化信息的一个限制性因素,即使生物体液的一维1H-NMR谱图(600MHz或者更高场强)就包含几千个信号。在研究中一个样品的NMR谱图可以被看作是多维的物体,每一个维度代表不同代谢物的浓度(也可以称为谱峰强调的分布)。因此,组织和生物体液的NMR谱图可以提供生命体的多维代谢指纹信息,并且由于疾病和毒性过程的不同代谢轮廓会有特异性的变化。基于此,计算机辅助的模式识别和专家分析系统已经成功被用于解释在多种毒理学实验状态下获得的NMR数据(Gartlandet al. 1991, Holmeset al. 1992, 1994, 1998a, b, Anthonyet al. 1994, Spraulet al. 1997, Beckwith-Hallet al. 1998)。这些统计学工具与目前在基因组学和蛋白质组学研究中使用的方法非常相似。最简单的方法就是将NMR信号强度数据看作代谢物浓度或者分泌速率的多样品矩阵。现阶段没有必要进行谱图归属,因为只是将它作为统计对象来处理。
模式识别通常是指在数学上减低多参数维度来进行科学假设和假设检验的一种数据分析方法,主成份分析就是其中最简单的一种。主成份是由多个原始变量经过加权后进行线性组合生成的新的变量。主成份有如下特征:(1)每个主成份之间相互正交;(2)第一主成份包含最多的数据方差信息,其它依次递减。因此,前两个或者三个主成份就代表了数据中所含的主要的生化信息的改变,这样的主成份图可以用于药物和毒素在不同器官中根据其毒理学机制聚类分析的可视化(Nicholson and Wilson 1989, Gartlandet al. 1991)。主成份分析不需要提前对样品进行分组,是一种非监督的分析方法,有时候聚类信息也可能在较小的主成份中体现。使用这种简单的代谢组学方法我们可以将来自于未知毒性化合物处理后的动物样品与NMR产生的代谢数据进行比较,进而确定它在模式识别图中的相似拟合度(Holmeset al. 1998a, b)。
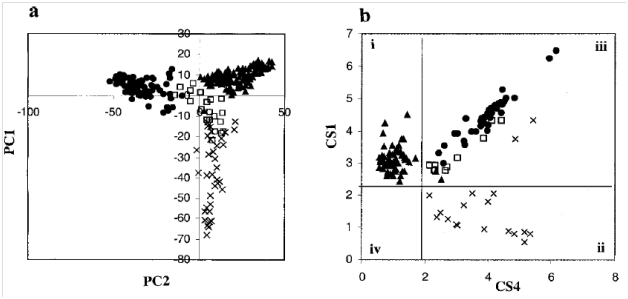
Figure 2. (a)不同毒素处理后的大鼠尿液谱图主成份分析得分图。(b) Cooman残差图
然而在真实情况下,毒理学数据会更为复杂,因为病变的发展和自愈过程是实时变化的。因此,NMR检测的代谢轮廓是随时间变化的(Holmeset al. 1992, Beckwith-Hallet al. 1998)。另外,在原始多维NMR代谢组空间比较外源化合物的效应会更为严格。作为一种可选和自动化毒性分类方法,NMR数据的监督分析已经被证明是有效的。监督模式下的数据分析,首先使用NMR代谢组学数据(称为训练集/training set)来构建一个数学模型可以准确预测每个样品的分类。接下来使用独立数据对根据训练集所建的计算模型的预测能力进行检验。这些模型也被人们称为专家系统,它们可以包括不同的数学程序,比如主成份、人工神经网络和规则归纳法等。所有情况下这些方法都允许定量描述多变量边界用以区分不同外源化合物的代谢效应。某些监督分析方法,比如SIMICA可以估算拟合相似性的可信度,使用类似的方法可以将样品归属为某一特定类型、多种类型的毒性或者不分类。
目前我们研究组构建的代谢组学专家系统主要具备以下三个不同水平的病理生理特征:
1)根据使用对照组数据建立起来的代谢组标准对样品进行二元分类(正常和异常)。
2)根据毒性和组织内发挥毒性的位置对靶器官进行分类。
3)鉴定所研究化合物毒理效应的生物标志物和毒性机制分类。
非常有趣的是,这些水平的分类也适用于基因组学和蛋白质组学研究,甚至临床诊断筛选过程。随着毒理学数据库数量的不断增长以及快速高通量NMR采样技术的提高,有必要采用像“模糊逻辑”类似的方法建立更精妙的专家系统,以满足分组之间边界决定更好的灵活性要求。上述代谢组学方法使开发专家系统原型用于在第一和第二水平对一系列毒理学终点事件和靶器官进行分类成为可能。第三水平的分类会有更为复杂的问题,具体的生物标志物信息可以从主成份载荷图中获取(Holmeset al. 1998b)。
总而言之,大量的生化、毒理学和临床化学问题可以使用高分辨率1H-NMR波谱技术分析生物样品来解决。目前简单的生物体液1H-NMR实验就可以为整个生命体的生化过程和毒理学生物标志物的种属差异提供意想不到的见解。随着仪器设备和技术的发展,代谢组学的应用越来越广泛。计算机辅助的模式识别和专家系统数据分析对促进基于NMR的代谢研究起到了至关重要的作用。代谢组学研究适用的其他重要领域包括基因修饰导致的生化改变、环境污染物的影响、药物治疗和效果的临床评估和特异质毒性等。最后,可以预见在不久的将来,可以整合基因组学、蛋白质组学和代谢组学数据形成更全面的生物组系统来整体评价体内功能紊乱。
笔者注释
在科学实验研究中,大家通常把大规模检测生物样品中的多种代谢物水平的研究都称为代谢组学研究。也有人把代谢组学分为非靶向代谢组学、靶向代谢组学及拟靶向代谢组学等,这些概念对理解检测分析方法的异同点会有帮助,但是其本身对科学研究的贡献其实并没有本质区别。研究人员可以根据具体的实验目的灵活选择。笔者更倾向于将代谢组学理解为结合仪器分析和化学计量学方法来同时研究多个小分子代谢物在生物样品中实时变化水平的方法技术学科。



