文献分享 | The EMBO Journal 新冠病毒免疫病理学和多器官损伤的血液分子标志物
新冠肺炎(COVID-19)已鉴定为SARS-CoV-2病毒感染,表现为免疫应答失去调节能力,代谢功能紊乱和多器官损伤。目前,新冠肺炎的全球疫情仍不容忽视,截至2021年6月27日,全球现存确诊病例29526909例,累计死亡2889592例。2020年,国际知名期刊EMBO J发表了一项来自复旦大学人类表型组研究院的研究内容,研究者对66例不同病程的新冠肺炎感染者的血液进行了转录组学,蛋白质组学和代谢组学分析,发现了在轻症和重症肺炎患者体内,许多组织特异性蛋白和胞外RNA具有显著改变。在肺炎向重症发展的病程中,中性粒细胞,IFN信号通路呈现慢性激活,炎症细胞因子水平升高;而轻症患者表现为强健的T细胞效应。这些结果是新冠肺炎发展和预后的重要指征,对了解预测新冠肺炎的病理生理学和疾病发展具有重要意义。
1. COVID-19 感染患者的免疫病理学变化
从66名不同病情的患者以及 17 名健康志愿者收集了血液和咽拭子样本(图1A)。为了确定 COVID-19 病理生理学是否与特定的分子变化相关,研究者结合转录组学、蛋白质组学和代谢组学的多组学方法检查了总共 23,373 个表达基因、9,439 个蛋白质、327 个代谢物和 769 个 exRNA(图 1B)。与健康对照相比,轻度和重度患者的表达基因有6.79%上调和26.0%的下调;这一表达模式(上调/下调)在蛋白质水平为52.1%和51.7%,在代谢物水平为7.34%和15.6%,在exRNAs中为 39.9%和20.5%(图 1C)。
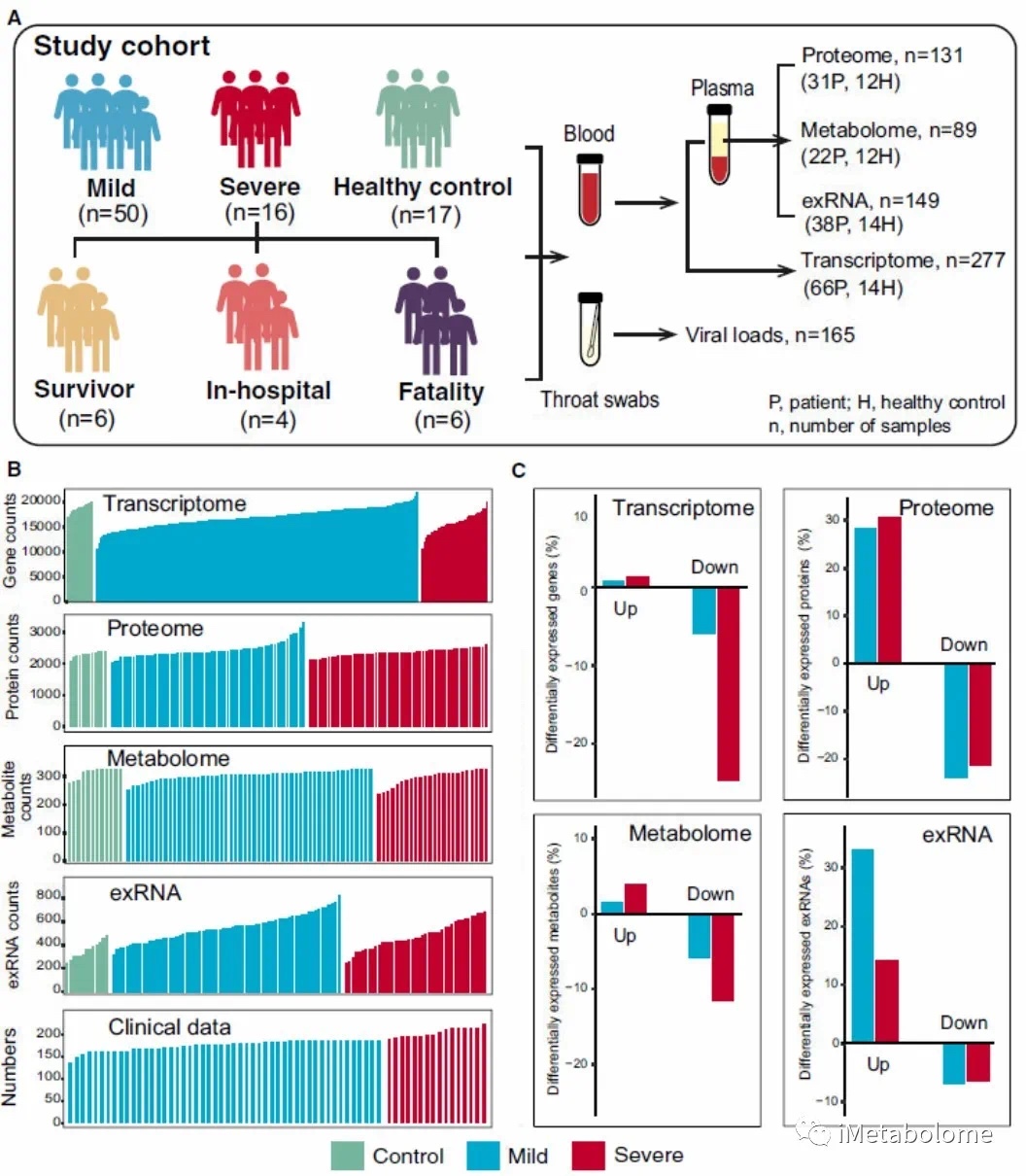
图1.实验设计和组学数据结果
值得注意的是,多组学数据与经典血液和生化参数之间存在显著相关性:轻症和重症患者的三羧酸循环 (TCA) 和糖酵解途径均显著下调。然而,这些患者的缺氧诱导因子 (HIF-1) 信号通路和宿主防御通路(T 细胞受体信号通路、ISG15 抗病毒信号通路)升高(图 2A)。此外,加权基因共表达网络分析 (WGCNA) 将蛋白质组图谱分成 33 个共表达模块 (ME0-ME32)。其中,六个模块显示出与临床参数的显著相关性(图 2B),特别是和活化部分凝血活酶时间 (APTT) 密切相关,其表达下调可能表明 APTT 值较高(图 2C)。相比之下,患者的血浆 IL-6 和 IL-10 水平与模块 15 中的蛋白质表达呈正相关(图 2D)。除蛋白质外,脂蛋白变异也与免疫变化显著相关,包括 IgG、单核细胞和降钙素原。综合起来,这些数据表明特定分子变异与 COVID-19 感染患者的病理生理变化之间存在关联。

图2. 与COVID-19病理生理学相关的蛋白质水平改变
轻度和重度患者血浆中肺增强蛋白的差异很大。在所有患者中都观察到 HIF-1 信号通路和活性氧代谢过程的激活(图 3D)。肝和脑增强蛋白也有显著差异,其次是来自睾丸、肠和其他器官的蛋白(图 3A)。同时,研究者还观察到调节神经递质合成(GLS、OGDH、DLD 等)、神经递质转运(GLUL、GLUD2、GLUD1)和神经递质受体(HTRA3、GRIK3 和GRIA3),以及包括 ENO1、MBP 和 NEFM 在内的蛋白质显著减少(图 3C 和 F)。调节甾醇和胆固醇转运的肝脏增强蛋白下调,而在轻度和重度患者中参与急性炎症反应的蛋白升高(图 3E)。参与细胞周期和细胞增殖的睾丸增强蛋白在所有男性患者中均上调,尽管与生殖相关的蛋白(例如 YBX2)显著下调。在 COVID-19 感染患者中,与心肌收缩和氧化还原相关的心脏特异性蛋白质减少(图 4C)。
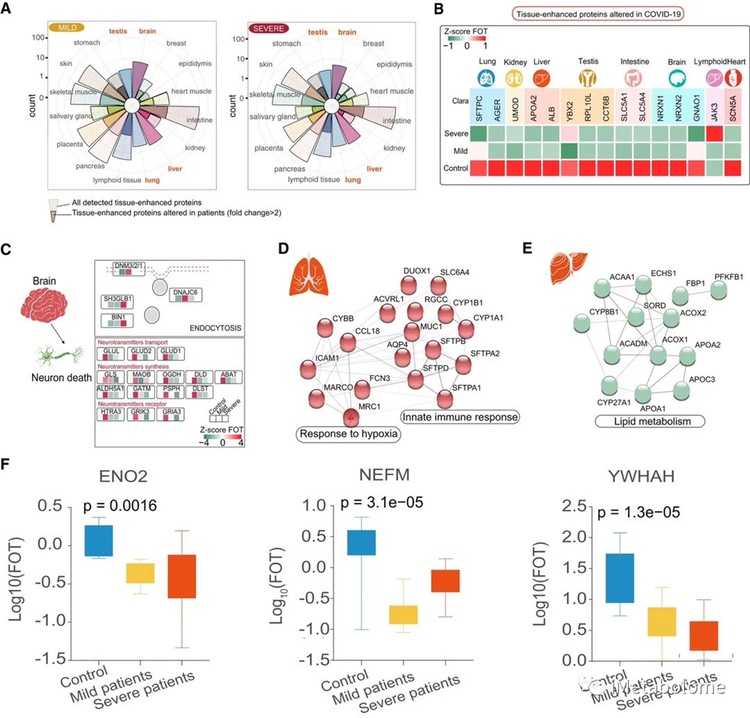
图3. COVID-19患者组织特异性蛋白质改变
研究者还研究了不同细胞群的相对比例和组织损伤相关 exRNA 的表达。(图 4A 和 B)。例如,肺泡 1/2 型上皮细胞(AT1 和 AT2)表达的一组蛋白质在所有患者中均显著下调(图 4B)。此外,在所有组织中,大多数与组织损伤相关的 exRNAs 显示出差异表达。一些组织增强蛋白和组织损伤相关 exRNA 的变异也与 COVID-19 的严重程度有关。例如,富含微管蛋白积累的脑增强蛋白在轻度疾病患者中上调。这些数据表明 COVID-19 可能影响多个器官。
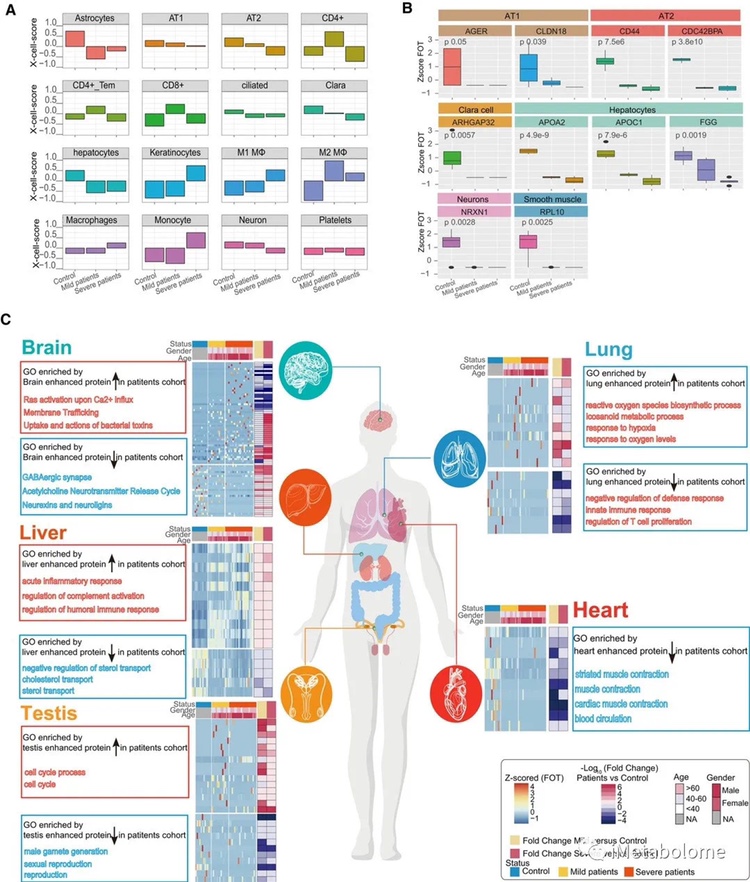
图4. COVID-19患者组织损伤
3. COVID-19 感染患者免疫病理学变化
全血转录组数据分析显示,在整个住院期间,重症患者的 IFN 信号持续激活(图 5A),与轻度患者相比,重症患者的 IL-6、IL-8 和 IL-10 水平显著增加。这些数据表明 IFN-I 信号的持续激活和高水平的炎性细胞因子可能会影响 COVID-19 的免疫病理学。
对中性粒细胞转录组特征的检查表明,中性粒细胞过度激活与严重而非轻度疾病有关。值得注意的是,编码与中性粒细胞胞外陷阱(NETs)相关分子的基因在严重疾病患者中显著上调(图 5B)。由于过量的 NET 形成会导致组织损伤,研究者的数据表明中性粒细胞的过度激活可能有助于 COVID-19 的发病机制。
与可以通过强 T 细胞反应清除的流感病毒一样,轻症患者的 SARS-CoV-2 免疫力的特点是强大的 T 细胞反应,反映在入院时 T 细胞信号激活(M7.3 模块、M35.1 模块)和 T 细胞分化(M19 模块),随后迅速减少(图 5A))。表明T 细胞反应对于成功抵御 SARS-CoV-2 的宿主防御是必不可少的。
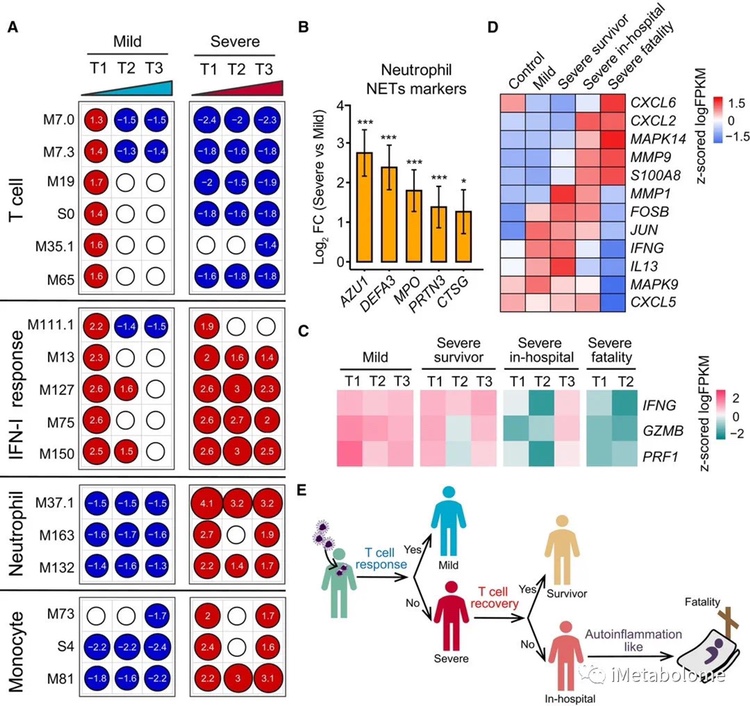
图5. COVID-19患者免疫应答差异
4. COVID-19感染患者脂蛋白代谢的综合变化
为了揭示 COVID-19 感染患者的代谢变化,研究者量化了代谢物、脂蛋白亚类的 348 个代谢物参数。PCA 评分图显示出明显的与病程变化相关的代谢组学轨迹(图 6A)。因此,血浆代谢物的浓度变化与 COVID-19 的严重程度有关。
进一步的统计分析突出了脂蛋白亚类及其组成成分的主要变化,包括 LDL1 (L1TG)、LDL4、VLDL5、HDL1 和 HDL4(图 6C )。与健康对照组相比,轻度和重度患者的LDL1中的甘油三酯(TG)和VLDL5所有脂质中的游离胆固醇(FC)水平均显著升高,而LDL4和LDL5、LDL中的胆固醇、胆固醇酯均显著降低。幸运的是,大多数这些脂蛋白在患者出院后恢复(图 6B和C).
参与脂蛋白代谢的一些关键蛋白质,包括可溶性低密度脂蛋白受体 (sLDLR)、卵磷脂胆固醇酰基转移酶 (LCAT) 和胆固醇酯转移蛋白 (CETP),在轻度和重度 COVID-19 中显著降低。(图 6D 和 E)。此外,与健康对照组相比,在 TCA 循环中的 ACO2、IDH、OGDH、DLD、SDH 和 MDH 等酶在 COVID-19 感染患者中较低,而对脂肪酸合成至关重要的酶(乙酰辅酶 A 羧化酶 [ACAC ] 和脂肪酸合成酶 [FASN]) 升高。与健康对照相比,在患者中可以观察到血浆乳酸和 LDH 的显著同时升高(图 6E)。这些数据揭示了 SARS-CoV-2 感染期间脂蛋白代谢、糖酵解和 TCA 循环的失调。
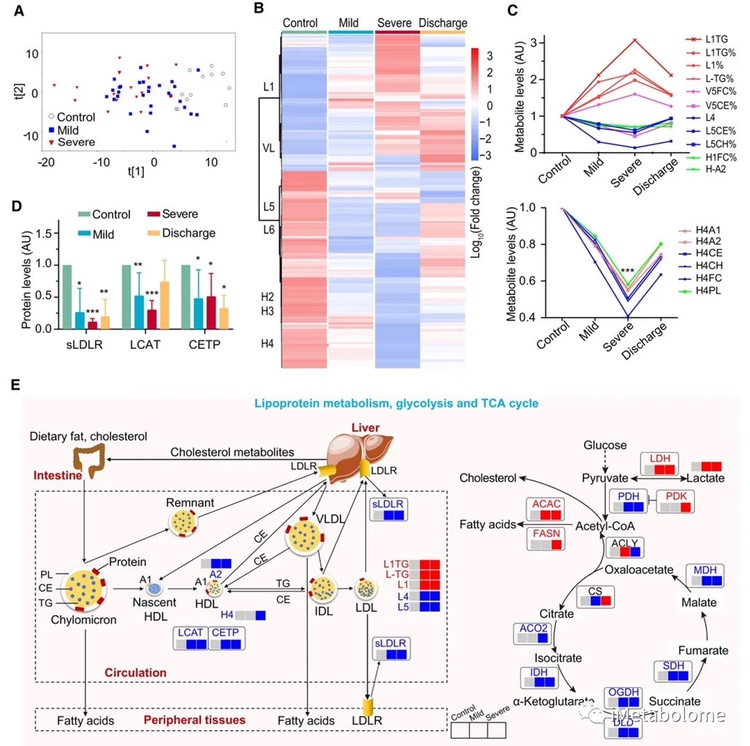
图6. COVID-19患者血浆代谢组差异
5. 病毒载量与严重 COVID-19 感染患者的疾病预后相关
COVID-19 的严重程度和临床结果也与病毒载量有关。总体而言,与存活者相比,入院时 5 例死亡病例咽拭子中的 SARS-CoV-2 RNA 载量显著更高(图 7A)。参与抗病毒过程的蛋白质,包括 TCR 和 BCR 信号通路,与重症幸存者的病毒载量变化呈正相关。此外,参与病毒生命周期过程的蛋白质,包括病毒mRNA 合成和先天免疫反应,仅与重症致死组的病毒载量变化呈正相关(图 7E)。值得注意的是,重症存活组中涉及线粒体功能、脂质代谢过程、类固醇激素过程和 TCA 循环等途径的蛋白质(例如,FASN、ACSS2、CPT1A、HADHB)持续上调(图 7B和 C)。然而,这种上调仅在重症致死组入院后的早期阶段观察到。令人惊讶的是,与病毒生命周期、病毒 RNA 合成和氧化应激相关的蛋白质(例如,EIF、EIFB、RPL19、SLCA24)在入院后的几个幸存者病例中下调,但在死亡患者中保持高水平(图 7B 和 D )。因此,SARS-CoV-2 可能会在感染期间利用宿主资源。
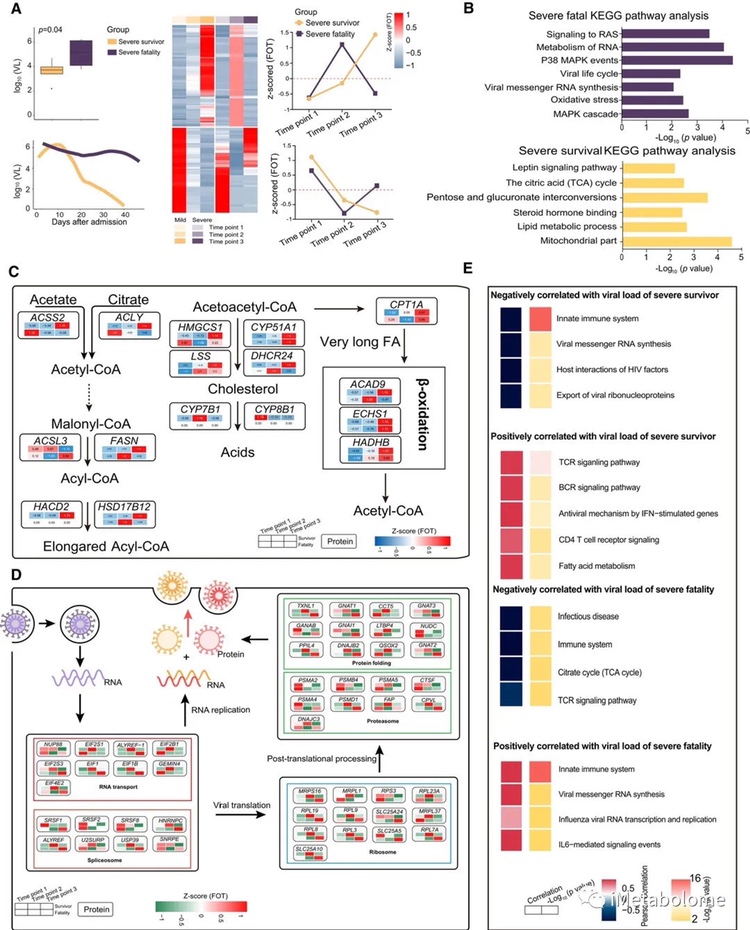
图7. COVID-19重症患者预后对比分析
6. 预测 COVID-19 感染患者临床结果的生物标志物
由于发现了许多与 COVID-19 病理生理学相关的分子表型,研究者利用第一时间点或所有时间点的 exRNA、mRNA、蛋白质组学数据和相应的临床协变量数据集,构建预测模型。PCA聚集成三种临床表型:(i)健康组;(ii) 感染患者且预后良好;(iii)感染患者且预后较差(图 8A)。基于所有四种类型数据的预测模型运行良好,表明入院时收集的所有四种类型的数据都包含关键的预后信息。
此外,研究者从四种类型的数据中各自确定了稳健的预测模型和生物标志物。每个数据集中的一两个特征(表达的基因、蛋白质、exRNA 和生化参数)能够清楚地将患者分为具有不同预后特征的两组(图 8D-I)。预后不良与 D-二聚体和纤维蛋白原降解产物水平升高以及 F13A1 表达降低有关(图 8H 和 I),表明凝血状态可能是监测 COVID-19 进展的关键因素之一。基于 mRNA 的模型显示不良预后与较低水平的 CD3E 和较高水平的 OLAH 相关,因此与 COVID-19 感染患者的免疫反应高度一致(图 8E)。此外,基于 exRNA 的预测因子包括 let-7 家族的成员(图 8D 和 E)。最后,基于蛋白质的模型突出了富含细胞外外泌体、脂蛋白代谢过程、先天免疫反应和血液凝固的特征(图8G 和 H)。
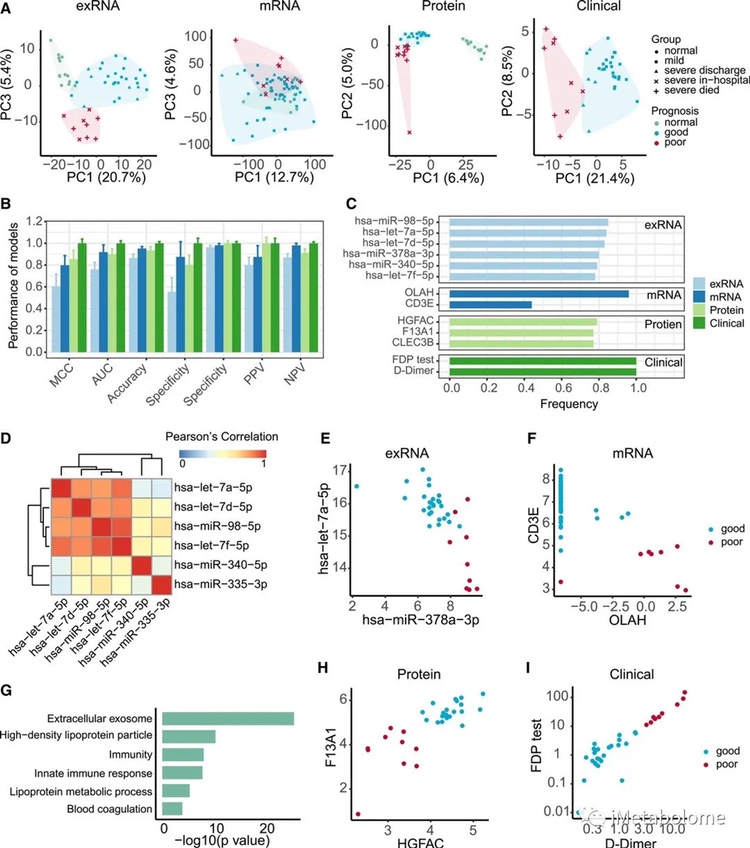
图8. COVID-19患者预后预测模型
COVID-19 的严重程度和临床结果与多器官损伤显著相关。由于 ACE2广泛存在,SARS-CoV -2 能够感染许多器官。除了肺炎,多项临床研究报告了住院 COVID-19 感染患者的轻度胃肠道、心血管症状和神经系统表现。组织病理学调查和尸检也记录了除肺以外的其他器官的损伤。
SARS-CoV-2 感染会导致患者发生急性肺损伤 (ALI),本研究数据显示,重症患者的 AT1 和 AT2 细胞数量显著减少,表明肺泡上皮遭到破坏,进而导致肺泡液积聚,进而引发缺氧;此外, HIF1a 信号改变,这可能会进一步恶化 ALI。因此,去除多余的肺泡液和恢复肺泡结构将具有重要的临床意义。
在另一方面,免疫病理生理学是一个极大影响 COVID-19 临床结果的因素。本研究纵向分析提供的证据表明,T 细胞动员成功的轻度或重度症状患者迅速控制了病情。相比之下,未能产生良好 T 细胞反应的重症患者保持持续的促炎反应,并遭受细胞因子风暴和过量的 NETs。
值得注意的是,与轻度和重度存活患者相比,p38信号,胶原酶(MMP9),嗜中性粒细胞化学-引诱(CXCL2和CXCL6)和S100A8这些炎症分子在重度致死患者中显著上调,前者也表现出 I 型干扰素反应的持续升高。总之,在非常严重的 COVID-19 病例中,自身炎症可能会放大疾病。缺乏来自其他呼吸道病原体的控制可能是这项研究的局限性,因此无法确信这些分子改变是否是COVID-19独有,SARS-CoV-2 的病理学和病理生理学及其与其他呼吸道病原体的差异值得进一步研究。
在这项研究中,在 COVID-19 开始阶段发现的一些分子与经典血液和生化参数显著相关,更重要的是与疾病严重程度相关。研究者分别建立了对于exRNAs、mRNA、蛋白质和生化参数的预测模型。在每种数据类型中仅使用一两个生物标志物就可以准确预测 COVID-19 的临床结果。此外,这些生物标志物可能具有与 COVID-19 病理生理学直接相关的生物学功能。例如,来自 exRNAs 的 let-7 家族、来自 mRNA 的 OLAH 和 CD3E 以及来自蛋白质组的 C4A 和 C4B 一致地揭示了 T 细胞活化和抑制炎症反应的重要性。然而,由于这里使用的患者样本量相对较小,显然需要做更多的工作来确认这些生物标志物的可靠性和实用性,尤其是在更大的队列中验证这些生物标志物的预测能力。
文章转自微信公众号iMetabolome




